DNA
「DNA」とは、リン酸と塩基と糖から構成されるデオキシリボ核酸のことを意味する表現である。
「DNA」とは・「DNA」の意味
「DNA」とは、デオキシリボ核酸(deoxyribonucleic acid)の略名で、リン酸・塩基・デオキシリボースと呼ばれる糖から構成されている。リン酸とは、オキソ酸の一種で、細胞の最外層を取り囲む膜である細胞膜の構成成分である。植物にとってのリン酸は重要な栄養分で、開花や、結実を促す。その他にも、根の成長や、発芽を助ける働きなどがある。デオキシリボースとは、5個の炭素原子を含む単糖類で、細胞を複製する役割がある。またDNAの塩基には、アデニン(A)・シトシン(C)・グアニン(G)・チミン(T)の4種類があり、アデニン(A)はチミン(C)と、グアニン(G)はシトシン(C)と水素結合しやすい。このリン酸、塩基、糖が結合したものをヌクレオチドと呼び、これらがいくつもつながったものを核酸と呼ぶ。したがって、ヌクレオチドは核酸の化学構造上の構成単位となる。
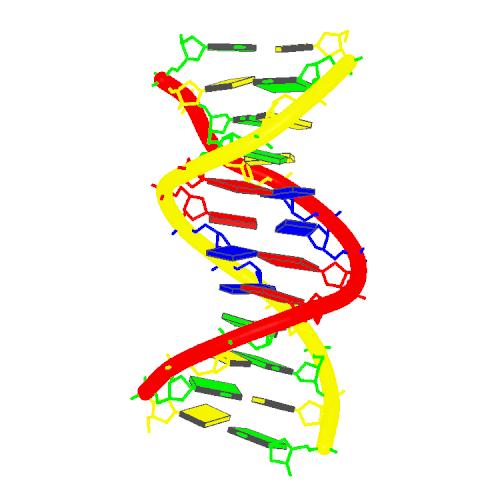
DNAがどこに存在しているかというと細胞核の中である。細胞核とは、細胞の中にある核のことで、ほぼすべての細胞に存在する。DNAは通常、二重らせん構造をして、この細胞核の中に存在している。そして、人体の違いやそれぞれの特徴は、このDNAの中にある塩基配列によって生まれてくる。塩基配列とは塩基の並び方のことをいう。つまり、塩基の並び方が遺伝情報ということになる。人の持っている塩基対は約60億個ともいわれていて、その並び方は膨大な数である。
しかし、全ての塩基配列に遺伝情報があるわけではなく、一部の配列のみ遺伝情報を持っている。この遺伝情報を持った一部のDNAのことを「遺伝子」と呼ぶ。遺伝子は「身体の設計図」や「タンパク質の設計図」と呼ばれ、遺伝子の情報に従ってタンパク質が作られる。そして、細胞の中ではタンパク質が中心となって働き、体を作っている。遺伝子やタンパク質は人体にとってとても重要な物質で、遺伝子やタンパク質がないと人体は成り立たないということになる。
遺伝子の「機能 3つ」には、転写・翻訳・複製が挙げられる。これら3つの機能は生物の基本的な遺伝子に関する法則であり、「セントラルドグマ」と提唱されている。転写とは、DNAが持っている遺伝情報がrnaに読み込まれることをいう。転写では、メッセンジャーrna (mrna)とトランスファーrna (trna)、リボソームrna (rrna)の3種類が作られる。遺伝子の情報に従ってタンパク質は作られるが、必ず遺伝情報をrnaに写してから作られることになる。
そして、rnaによって受け渡された遺伝情報が、タンパク質に変換されることを翻訳という。rnaは、DNAに似た物質であるが、DNAとrnaでは一部の塩基が異なる。rnaでは、チミン(T)の代わりにウラシル(U)が使われている。したがって、塩基対もアデニン(A)とウラシル(U)になる。rnaは、転写・翻訳の働き以外にも、酵素になったり、ウイルスの遺伝情報を担ったりと多種多様な働きをしている。複製は、細胞分裂する際にDNAがコピーされ、保存される過程のことをいう。
DNAを調べることができる子供向けのキットも販売されている。野菜や肉、自分の唾液からDNAを簡単に取り出すことができる。DNAについて小学生向けに説明する時は、図や写真が載っている本や、実際に自分でDNAを取り出すことができるキットを使うことで、より分かりやすく説明することができるだろう。
中学生では、期末試験や高校入試の問題でDNAについて出題されることが考えられる。特にDNAと遺伝子の違いについてはよく出題されるテーマなため、しっかりポイントを押さえ説明できるようにしておいた方がよい。DNAは生物の基本であり、高校の生物の授業においてもより深く習う。そのため、DNAについて可能な限り知識を深めておくことは、高校の生物の授業を習う上でも役に立つだろう。
DNA
別表記:デオキシリボ核酸、deoxyribonucleic acid
「デオキシリボ核酸(DNA)」とは生体の遺伝情報を保持している物質である。
【DNAの語源】
デオキシリボ核酸は英語の名称である「deoxyribonucleic acid」の直接的な和訳である。略称としてよく用いられる「DNA」は、Deoxyribo-Nucleic Acidの頭文字である。Deoxyribo(デオキシリボ)-Nucleic(核)-Acid(酸)という構図であり、つまり「DNA」と「デオキシリボ核酸」は同義である。
【DNAの説明】
デオキシリボ核酸は、五炭糖(デオキシリボース)とリン酸、および4種の塩基(アデニン・グァニン・シトシン・チミン)で構成された高分子である。2本の螺旋状の線が塩基で結合された「二重らせん構造」であることがよく知られている。
【DNAの類語】
「遺伝子」は、遺伝情報を伝達する要素という意味合いの言葉である。具体的な物質を指す意味合いにおいては「遺伝子=デオキシリボ核酸(DNA)」といえるが、DNAを含むすべての遺伝物質・遺伝情報の総称として「遺伝子」と呼ぶことも多々あり、必ずしも全ての文脈で「遺伝子=DNA」という理解が当てはまるとは限らない。
【DNAの関連語】
DNA鑑定とは、生体のDNAのパターンを解析することで固体の同定を行う技術および同定法のことである。「DNA型鑑定」とも呼ばれる。DNAは個人ごと・固体ごとに微妙な違いがあり、個人・固体のDNAは生涯不変であるため、極めて高精度な個人識別が実現できる。
ディー‐エヌ‐エー【DNA】
読み方:でぃーえぬえー
1 ⇒デオキシリボ核酸
2 俗に、遺伝子のこと。また、先祖から子孫へ連綿と伝わるもの。「父の—を受け継ぐ」「歴代モデルの—を引き継いだ新車」「ジャーナリスト精神の—を継承する」
ディー‐エヌ‐エー【DNA】
DNA
デオキシリボ核酸
デオキシリボ核酸(DNA)は、生物の遺伝情報の担い手である。塩基(プリンとピリミジン)、五単糖(デオキシリボース)、リン酸から成るヌクレオチドが重合した高分子で、二重らせん構造をとる。
| 化合物名や化合物に関係する事項: | デオキシリボヌクレオシド デオキシリボヌクレオチド デオキシリボース デオキシリボ核酸 デメチルクロルテトラサイクリン デンプン トリチウムグアノシン |
DNA
DNA → デオキシリボ核酸

CC Attribution-Noncommercial-Share Alike 3.0 Unported
デオキシリボ核酸 (DNA)
構造

CC Attribution-Noncommercial-Share Alike 3.0 Unported
デオキシリボ核酸
DNA(デオキシリボ核酸) ( Deoxyribonucleic Acid )
DNA
【概要】 デオキシリボ核酸。遺伝子をつくっているもの。細胞の核やミトコンドリアの中にある。二本つらなってらせん階段のような形をして、つまり2種類のヌクレオチドが横に手をつないで「はしご」になっている。ヌクレオチドはアデニン(A)、シトシン(C)、チミン(T)、グアニン(G)の4種類の塩基(ヌクレオシド)でできている。3つづつの塩基の並びが、特定のアミノ酸を指定した信号になっていて、コドンと呼ばれる。アミノ酸が続くとペプチド、ペプチドが繋がると蛋白質になる。つまり遺伝子で伝えるのは蛋白質の設計図である。
【詳しく】 DNAの複製は、まずはしごを縦に割る。左右に別れたヌクレオチドに、ぴったり合うヌクレオシドがくっつき、縦の紐がくっつけば、うり二つの2本のはしごができる。この作業はDNAポリメラーゼという酵素が働く。
DNA
ボース(糖)とリン酸、塩基から構成されています。この DNAは四種類の分子
塩基がアデニン(A)、グアニン(G)、シトシン(C)、チミン(T)の四種類
があります)が連なった長大な二本鎖からなる分子で、必ず一方の鎖のAと他方の鎖のT、また一方のGと他方のCが対合し、二本のDNA 鎖は全体として二重らせん構造をとっています。この相補的二本鎖構造は、元のDNA を鋳型にして元と全く同じコピーを作ることができ(DNAの複製)、生体内で一個の細胞が分裂して複製された二個になるとき、複製された二本のDNA鎖が二個の細胞に分配され遺伝情報を伝えていきます。
DNA (曖昧さ回避)
(DNA から転送)
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2024/12/10 15:00 UTC 版)
DNA(ディーエヌエー)
頭字語
- デオキシリボ核酸 (Deoxyribonucleic acid)
- デルニエール・ヌーベル・ダルザス (Dernieres Nouvelles d'Alsace) - フランス・アルザス地方で発行されている日刊紙。
- デジタルネットワークアニメーション(Digital Network Animation) - 日本のアニメ制作会社。
- ダグラス・ノエル・アダムズ (Douglas Noël Adams) - 「銀河ヒッチハイク・ガイド」で知られる作家。
- DDT NEW ATTITUDE - DDTプロレスリングのプロジェクト。
- Cisco DNA - Cisco Digital Network Architectureの略。 Ciscoが提唱するインテントベースネットワークを企業ネットワークに適用するためのアーキテクチャ。
- DIGITAL Network Architecture - DECが提唱したネットワークアーキテクチャー。
- デイリーニュース&アナリスト - インドの新聞。 Daily News & Analysis
- Windows DNA (Windows Distributed interNet Application) - マイクロソフトの提唱するアプリケーションフレームワーク。
- Digital Network Architecture - Ciscoが提唱する意図主導型ネットワークを企業ネットワークに適用するためのアーキテクチャ。
コード
音楽
アルバム
- D・N・A - Janne Da Arcのアルバム。
- D.N.A (miCKunのアルバム)(ディー.エン.エー) - miCKun(mihimaru GT)のアルバム。
- DNA (リトル・ミックスのアルバム) - リトル・ミックスのアルバム。表題曲を収録。
- DNA (MONKEY MAJIKのアルバム) - MONKEY MAJIKのアルバム。
- DNA (倖田來未のアルバム) - 倖田來未のアルバム。
- DNA (バックストリート・ボーイズのアルバム) - バックストリート・ボーイズのアルバム。
- D.N.A (Aぇ! groupのアルバム) - Aぇ! groupのアルバム
楽曲
- DNA (川本真琴の曲) - 川本真琴のシングル。
- DNA (BTSの曲) - BTS(防弾少年団)のシングル『MIC Drop/DNA/Crystal Snow』に収録
その他
- DNA (バンド) - アート・リンゼイが結成したバンド。
グラフィック関係
- DNA (企業) - 日本のグラフィックデザイン会社。
映画・漫画
- D・N・A² 〜何処かで失くしたあいつのアイツ〜 - 桂正和の漫画・アニメ作品
- D.N.A./ドクター・モローの島 - 1996年公開のアメリカ映画。日本での劇場公開時は『D.N.A.』というタイトル。
- en:DNA (1997 film) - 1997年公開のアメリカ映画「D.N.A.II」の原題。
- D・N・ANGEL - 杉崎ゆきるの漫画・アニメ作品
架空
- DNA - テレビゲーム『電脳戦機バーチャロン』に登場する架空の軍事組織。電脳戦機バーチャロン#組織を参照。
- DNA - アニメ『メタルファイト ベイブレード ZEROG』に登場する架空の組織。詳細はメタルファイト ベイブレード ZEROG#作中用語を参照。
その他
- D.N.A. 〜Dark Native Apostle〜 - ハドソンから発売されたPlayStation 2用のゲームソフト。
- DNA (小惑星) - 小惑星帯に属する小惑星の1つ。
- D・N・A (お笑いコンビ) - 吉本興業に所属していたお笑いコンビ。
- スタジオDNA - 日本の出版社である、一迅社の旧称。
- D.N.A (どうでしょう・なびげーと・あんちゃん) - かつて放送されていた「水曜どうでしょう」の再放送版『どうでしょうリターンズ』における、安田顕の肩書き。
- DNAシリーズ - 横浜ゴムの自動車用タイヤの商標名
- 上記に関連して、横浜ゴム提供のTOKYO FM系ラジオ番組『Driving Navigator by ADVAN』の略称。
関連項目
D・N・A
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/01/10 01:33 UTC 版)

|
この記事は検証可能な参考文献や出典が全く示されていないか、不十分です。 (2023年5月)
|
| 『D・N・A』 | ||||
|---|---|---|---|---|
| Janne Da Arc の スタジオ・アルバム | ||||
| リリース | ||||
| ジャンル | J-POP ロック |
|||
| 時間 | ||||
| レーベル | motorod | |||
| プロデュース | Janne Da Arc 明石昌夫 秦野猛行 |
|||
| チャート最高順位 | ||||
|
||||
| Janne Da Arc アルバム 年表 | ||||
|
||||
| 『D・N・A』収録のシングル | ||||
|
||||
『D・N・A』(ディー・エヌ・エー)は、日本のヴィジュアル系ロックバンド・Janne Da Arcが2000年3月8日にmotorodから発売したメジャー1枚目のオリジナルアルバムである。
内容
- 1stシングル「RED ZONE」から3rdシングル「EDEN 〜君がいない〜」までの3曲と、後にシングルカットされる4thシングル「Heaven's Place/Vanity」、他7曲が収録されている。
- kiyoは今作ではじめてウーリッツァーピアノを使用した。
- 「D・N・A」の由来は遺伝子(デオキシリボ核酸)ではなく、「Different Native Answers(異なった自然の答え達)」という意味。
収録曲
| # | タイトル | 作詞 | 作曲 | 編曲 | 時間 |
|---|---|---|---|---|---|
| 1. | 「Deja-vu」 | kiyo | kiyo、Janne Da Arc、秦野猛行 | ||
| 2. | 「Vanity」 | yasu | yasu | yasu、Janne Da Arc、明石昌夫 | |
| 3. | 「ファントム」 | yasu | kiyo、yasu | kiyo、Janne Da Arc、明石昌夫、秦野猛行 | |
| 4. | 「EDEN〜君がいない〜」 | yasu | yasu | yasu、Janne Da Arc、明石昌夫、秦野猛行 | |
| 5. | 「child vision〜絵本の中の綺麗な魔女〜」 | yasu | kiyo | kiyo、Janne Da Arc、秦野猛行 | |
| 6. | 「Stranger」 | yasu | you、yasu | you、Janne Da Arc、明石昌夫、秦野猛行 | |
| 7. | 「桜」 | yasu | ka-yu | ka-yu、Janne Da Arc、秦野猛行 | |
| 8. | 「Lunatic Gate」 | yasu | you、yasu | you、Janne Da Arc、明石昌夫 | |
| 9. | 「Junky Walker」 | yasu | kiyo、yasu | kiyo、Janne Da Arc、秦野猛行 | |
| 10. | 「RED ZONE (Album Mix)」 | yasu | yasu | yasu、Janne Da Arc、明石昌夫 | |
| 11. | 「ring」 | ka-yu | ka-yu、yasu | ka-yu、Janne Da Arc、明石昌夫 | |
| 12. | 「Heaven's Place」 | yasu | yasu | yasu、Janne Da Arc、秦野猛行 | |
|
合計時間:
|
|||||
解説
- Deja-vu
- 今作のオーバーチュア。
- Vanity
- 両A面からなる、4thシングルの表題2曲目。
- ファントム
- EDEN〜君がいない〜
- 3rdシングルの表題曲。
- child vision〜絵本の中の綺麗な魔女〜
- Stranger
- 桜
- Lunatic Gate
- 2ndシングルの表題曲。
- Junky Walker
- RED ZONE (Album Mix)
- 1stシングルの表題曲のアルバムバージョン。
- ring
- Heaven's Place
- 両A面からなる4thシングルの表題1曲目。
参加ミュージシャン
- Janne Da Arc
- Support Musician
- 石原愼一郎:Right Side Guitar Solo (#6)
タイアップ
- アイディアファクトリー製PlayStation 2専用ゲームソフト『スカイサーファー』オープニングテーマ (#2)
- テレビ東京系列バラエティ番組『スキヤキ!!ロンドンブーツ大作戦』エンディングテーマ (#4)
- テレビ朝日系列討論バラエティ番組『ビートたけしのTVタックル』エンディングテーマ (#8)
- テレビ朝日系列バラエティ番組『ネプいっ!』エンディングテーマ (#10)
- テレビ東京系列リアリティ番組『ASAYAN』エンディングテーマ (#12)
- アイディアファクトリー製PlayStation 2専用ゲームソフト『スカイサーファー』エンディングテーマ (#12)
脚注
注釈
出典
外部リンク
デオキシリボ核酸
(DNA から転送)
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/09/09 05:50 UTC 版)


| 遺伝学 |
|---|
 |
デオキシリボ核酸(デオキシリボかくさん、英: deoxyribonucleic acid、DNA[1])は、2本のポリヌクレオチド鎖が互いに巻きついて二重らせんを形成しているポリマーである。このポリマーは、すべての既知の生物と多くのウイルスの発生、機能、成長、および生殖のための遺伝的命令を伝達する。DNAはリボ核酸(英: ribonucleic acid、RNA)とともに核酸と総称される。核酸はタンパク質、脂質、複合多糖と並んで、すべての既知の生命体にとって不可欠な4大生体高分子のひとつである。
DNAの二本鎖は、ヌクレオチドと呼ばれるより単純な単量体単位から構成されていることから、ポリヌクレオチドと呼ばれる[2][3]。各ヌクレオチドは、4つの窒素含有核酸塩基(シトシン: C、グアニン: G、アデニン: A、チミン: T)のうちの1つ、デオキシリボースと呼ばれる糖、およびリン酸基で構成されている。あるヌクレオチドの糖と、次のヌクレオチドのリン酸が共有結合(ホスホジエステル結合と呼ばれる)によって鎖状に結合し、糖-リン酸が交互に繰り返される主鎖が形成される。二本のポリヌクレオチド鎖の窒素塩基は、塩基対合則(AとT、CとG)に従って水素結合で結合し、二本鎖DNAを形成する。窒素塩基は、単環のピリミジンと二重環のプリンという2つのグループに分類される。DNAでは、チミンとシトシンがピリミジン、アデニンとグアニンがプリンである。
二本鎖DNAの両鎖は同一の生物学的情報を保存している。この情報は2本の鎖が分離するときに複製される。DNAの大部分(ヒトでは98%以上)はノンコーディングであり、これらの部分はタンパク質配列のパターンとしては機能しない。DNAの2本の鎖は互いに反対方向に走っているため、逆平行になっている。それぞれの糖には4種類の核酸塩基(または塩基)のうちの1つが結合している。遺伝情報をコード(符号化)するのは、主鎖に沿ったこれら4種類の核酸塩基の配列である。RNA(リボ核酸)鎖はDNA鎖を鋳型として転写と呼ばれる過程で作られ、その際にDNA塩基は対応する塩基と交換されるが、チミン(T)の場合は例外で、RNAはウラシル(U)と交換する[4]。これらのRNA鎖は翻訳と呼ばれる過程で、遺伝暗号に基づいてタンパク質のアミノ酸配列を決定する。
真核細胞では、DNAは染色体と呼ばれる長い構造体に組織化されている。これらの染色体は、通常の細胞分裂の前にDNA複製過程で複製され、それぞれの娘細胞に完全な染色体の集合を提供する。真核生物(動物、植物、真菌類、原生生物)はDNAの大部分を核DNAとして細胞核内に保存し、一部をミトコンドリアDNAとしてミトコンドリア内、あるいは葉緑体DNAとして葉緑体内に保存している[5]。対照的に、原核生物(細菌と古細菌)はDNAを細胞質内の環状染色体にのみ保存している。真核生物の染色体内では、ヒストンなどのクロマチンタンパク質がDNAを小さくまとめて組織化している。これらの緻密な構造は、DNAと他のタンパク質との相互作用を導き、DNAのどの部分が転写されるかを制御するのに役立っている。
特性

DNAはヌクレオチドと呼ばれる反復単位からなる長いポリマーである[6][7]。DNAの構造はその長さに沿って動的であり、密なループを作ったり、他の形状に巻きつくことができる[8]。どの生物種においても、DNAは水素結合で結合した2本のらせん状の鎖で構成されている。両方の鎖とも、同じ軸にらせん状に巻かれ、ピッチも同じで34オングストローム (3.4 nm)である。一対の鎖の半径は10 Å (1.0 nm)である[9]。別の研究によると、別の溶液中で測定した場合、DNA鎖の幅は22–26 Å (2.2–2.6 nm)、1ヌクレオチド単位の長さは3.3 Å (0.33 nm)であった[10]。ほとんどのDNAの浮力密度は1.7 g/cm3である[11]。
通常、DNAは一本の鎖として存在するのではなく、一対の鎖がしっかりと結合して存在する[9][12]。この2本の長い鎖は互いに巻きついて二重らせんを形成している。ヌクレオチドには、DNA分子の主鎖の一部(鎖を構成する)と核酸塩基(らせん内部でもう一方のDNA鎖と相互作用する)の両方が含まれている。糖と結合した核酸塩基はヌクレオシド(英: nucleoside)と呼ばれ、これに対し糖と1つ以上のリン酸基と結合した塩基はヌクレオチド(英: nucleotide)と呼ばれる。(DNAのように)複数のヌクレオチドが結合した生体高分子をポリヌクレオチドと呼ぶ[13]。
DNA鎖の主鎖はリン酸基と糖基が交互に結合してできている[14]。DNAの糖は2-デオキシリボースで、ペントース(炭素数5、五炭糖)の一種である。糖と糖は、隣接する糖環の3位と5位の炭素原子間にホスホジエステル結合を形成するリン酸基によって結合している。これらの炭素はそれぞれ、3'末端(three prime end)、5'末端(five prime end)と呼ばれる。プライム記号(')は、デオキシリボースがグリコシド結合を形成する塩基の炭素原子と区別するために使われる[12]。
このようにDNA鎖には通常、リボースの5'炭素に結合したリン酸基(5'ホスホリル)を持つ末端と、リボースの3'炭素に結合した遊離ヒドロキシ基(3'ヒドロキシ)を持つ末端がある。糖-リン酸骨格に沿った3’と5'炭素の配向は、各DNA鎖に方向性(極性とも呼ばれる)を与える。核酸の二重らせんでは、一方の鎖のヌクレオチドの方向ともう一方の鎖のヌクレオチドの方向は反対で、逆平行になっている。DNA鎖の非対称末端については、5'末端方向と3'末端方向という方向性を有し、5'末端はリン酸基を有し、3'末端はヒドロキシ基を有すると呼ばれる。DNAとRNAの大きな違いの一つは糖で、DNAの2-デオキシリボースがRNAではペントース糖のリボースに置き換えられている[12]。

DNA二重らせんは、ヌクレオチド間の水素結合と、芳香族性核酸塩基間の塩基スタッキング相互作用という、主に2つの力によって安定化されている[16]。DNAに含まれる4つの塩基は、アデニン(A)、シトシン( C)、グアニン( G)、チミン( T)である。これらの4つの塩基は、アデノシン一リン酸で示したように、糖-リン酸に結合して完全なヌクレオチドを形成する。アデニンはチミンと対になり、グアニンはシトシンと対になり、それぞれ A-T と G-C の塩基対を形成する[17][18]。
核酸塩基の分類
核酸塩基は、5員および6員の縮合複素環式化合物であるプリン A と G と、6員環のピリミジン C と T の2種類に分類される[12]。第5のピリミジン核酸塩基であるウラシル( U)は通常、RNA内でチミンの代わりを担い、その環上にメチル基を持たない点でチミンと異なる。RNAとDNAに加えて、多くの人工核酸類似体が核酸の特性を研究するため、あるいはバイオテクノロジーで使用するために作成されてきた[19]。
非標準塩基
DNAには修飾塩基が存在する。このうち最初に認識されたのは5-メチルシトシンで、1925年に、結核菌(Mycobacterium tuberculosis)のゲノムから発見された[20]。細菌ウイルス(バクテリオファージ)にこうした非標準塩基(英: noncanonical base)が存在する理由は、細菌に存在する制限酵素を避けるためである。この酵素系は、少なくとも部分的には、細菌をウイルス感染から保護する分子免疫系として働く[21]。より一般的な修飾DNA塩基であるシトシンとアデニンの修飾は、動植物における遺伝子発現のエピジェネティック制御(後成的調整)において、重要な役割を果たしている[22]。
DNAには多くの非標準塩基が存在することが知られている[23]。これらのほとんどは、ウラシルを含む標準塩基(英: canonical base)が修飾されたものである。
- 修飾アデニン
- N6-カルバモイル-メチルアデニン
- N6-メチルアデニン
- 修飾グアニン
- 7-デアザグアニン
- 7-メチルグアニン
- 修飾シトシン
- N4-メチルシトシン
- 5-カルボキシルシトシン
- 5-ホルミルシトシン
- 5-グリコシルヒドロキシメチルシトシン
- 5-ヒドロキシシトシン
- 5-メチルシトシン
- 修飾チミジン
- α-グルタミルチミジン
- α-プトレシニルチミン
- ウラシルおよび修飾物
- 塩基J
- ウラシル
- 5-ジヒドロキシペンタウラシル
- 5-ヒドロキシメチルデオキシウラシル
- その他
- デオキシアルケオシン
- 2,6-ジアミノプリン(2-アミノアデニン)
主溝と副溝

二本のらせん鎖がDNAの主鎖を形成している。もう一つの二重らせんが、その鎖と鎖の間にある空隙、あるいは溝をたどって見いだされる。これらの空隙は塩基対に隣接しており、結合部位となる可能性がある。鎖は互いに対称に配置されていないため、溝の大きさは不均等である。主溝(しゅこう)の幅は22オングストローム (2.2 nm)で、副溝(ふくこう)の幅は12 Å (1.2 nm)である[24]。主溝の方が幅が広いため、塩基の端は副溝よりも主溝の方が近づきやすい。その結果、二本鎖DNAの特異的配列に結合できる転写因子などのタンパク質は、通常、主溝に露出した塩基の側面に接触する傾向がある[25]。このような状況は細胞内のDNAの異常なコンホメーション(立体配座)によって異なるが、主溝と副溝はDNAを通常のB型に巻き戻した場合に見られる幅の違いを反映するよう常に命名されている。
塩基対合
DNAの二重らせんでは、一方の鎖上にあるそれぞれの核酸塩基が、もう一方の鎖上のただ一種類の核酸塩基と結合する。これは相補的塩基対形成(英: complementary base pairing)と呼ばれる。プリンとピリミジンは対合して水素結合を形成し、アデニンとチミンは2本、シトシンとグアニンは3本の水素結合を形成する。このように、二重らせんを挟んで(6炭素環から6炭素環へ)2つのヌクレオチドが結合対を形成する配置は、ワトソン・クリック塩基対と呼ばれる。 GC含量の高いDNAは GC含量の低いDNAよりも安定である。フーグスティーン塩基対(英: Hoogsteen base pair、6炭素環と5炭素環の水素結合)は、塩基対形成のまれな変種である[26]。共有結合と異なり、水素結合は比較的簡単に切断したり再結合したりすることができる。そのため二重らせんを構成するDNAの二本鎖は、機械的な力や高温によってファスナーのように引き離すことができる[27]。この塩基対の相補性の結果、DNAらせんの二本鎖配列のすべての情報がそれぞれの鎖に複製され、これはDNA複製に不可欠である。相補的な塩基対間のこの可逆的で特異的な相互作用は、生物におけるDNAのすべての機能にとって重要である[7]。
ssDNAとdsDNA
上述したように、ほとんどのDNA分子は実際には2本のポリマー鎖であり、非共有結合によってらせん状に結合している。この二本鎖DNA構造(英: double-stranded DNA、dsDNA)は、主に鎖内塩基スタッキング相互作用( G,Cスタックが最も強い)によって維持されている。この2本の鎖は、融解(melting)と呼ばれる過程を経て分離し、2本の一本鎖DNA分子(英: single-stranded DNA、ssDNA)を形成することがある。融解は、高温、低塩、高pHの条件下で起こる(低pHもDNAを融解させるが、DNAは酸-脱プリン化により不安定であるため、低pHはほとんど行われない)。
dsDNA型の安定性は、 GC含有( G,C塩基対の割合)だけでなく、配列(スタッキングは配列特異的であるため)および長さ(分子が長いほど安定)にも依存する。安定性はさまざまな方法で測定できる。一般的な方法は融解温度(Tm値とも呼ばれる)であり、二本鎖分子の50%が一本鎖分子に変換される温度である。融解温度はDNAのイオン強度と濃度に依存する。したがって、 GC塩基対の割合とDNA二重らせんの全長の両方が、DNAの二本鎖間の結合の強さを決定する。 GC含量が高く長いDNAらせんは相互作用が強い鎖が多く、 AT含量が高く短いDNAらせんは相互作用が弱い鎖が多い[28]。生物学では、DNA二重らせんのうち分離しやすい部分、たとえば一部のプロモーターに含まれる TATAAT プリブノー・ボックスなどは、鎖を引き離しやすくするために AT含量が高くなる傾向がある[29]。
実験室では、水素結合の半分を切断するのに必要な融解温度Tmを求めることにより、この相互作用の強さを測定することができる。DNA二重らせん内の塩基対がすべて融解すると鎖は分離し、溶液中に完全に独立した2つの分子として存在する。これらの一本鎖DNA分子には単一の共通形状は存在しないが、いくつかのコンホメーションは他のものよりも安定している[30]。
含有量

ヒトの場合、細胞1個あたり、女性の二倍体核ゲノムの総長は6.37ギガ塩基対(Gbp)に及び、長さは208.23 cm、質量は6.51 pgである[31]。男性の値はそれぞれ、6.27 Gbp、205.00 cm、6.41 pgである[31]。各DNAポリマーは、1番染色体のように数億ものヌクレオチドを含むことがある。1番染色体は約2億2千万塩基対からなるヒト最大の染色体で、まっすぐに伸ばすと85 mmの長さになる[32]。
真核生物には、核DNAのほかにミトコンドリアDNA(mtDNA)もあり、ミトコンドリアで使われる特定のタンパク質をコードしている。mtDNAは通常、核DNAに比べて比較的小さい。たとえば、ヒトのミトコンドリアDNAは閉じた環状分子を形成し、それぞれの分子は16,569個[33][34]のDNA塩基対を含み[35]、そうした各分子には通常、ミトコンドリア遺伝子の完全な集合が含まれる。ヒトの各ミトコンドリアには、このようなmtDNA分子が平均して約5個含まれている[35]。各ヒト細胞は約100個のミトコンドリアを含むので、ヒト細胞あたりのmtDNA分子の総数は約500個となる[35]。ただし、細胞あたりのミトコンドリアの量も細胞の種類によって異なり、卵細胞には10万個のミトコンドリアが含まれることがあり、ミトコンドリアゲノム(細胞のDNAの最大90%を構成する)の最大150万コピーに相当する[36]。
センスとアンチセンス
あるDNA配列が、タンパク質に翻訳されるメッセンジャーRNAのコピーと同じである場合、「センス配列」(英: sense sequence)と呼ばれる[37]。反対側の鎖の配列は「アンチセンス配列」(英: antisense sequence)と呼ばれる。センス配列とアンチセンス配列は、同じDNA鎖の異なる部分に存在することがある(すなわち、両方の鎖がセンス配列とアンチセンス配列の両方を含む)。原核生物でも真核生物でもアンチセンスRNA配列が作られるが、これらのRNAの機能は完全には解明されていない[38]。一つの提案は、アンチセンスRNAがRNA-RNA塩基対形成を通じて遺伝子発現の調節に関与しているというものである[39]。
原核生物や真核生物のDNA配列、そしてプラスミドやウイルスではより多くのDNA配列が、オーバーラップ遺伝子(英: overlapping gene)を持つことによってセンス鎖とアンチセンス鎖の区別をあいまいにしている[40]。このような場合、DNA配列の中には、一方の鎖に沿って読まれると一方のタンパク質をコードし、もう一方の鎖に沿って逆方向に読まれるともう一方のタンパク質をコードするという、二重の役割を果たすものがある。細菌では、この重畳が遺伝子転写の調節に関与している可能性がある[41]。一方、ウイルスでは、オーバーラップ遺伝子によって、小さなウイルスゲノム内にコードできる情報量を増加させる[42]。
スーパーコイル
DNAは、DNAスーパーコイル(英: DNA supercoiling、DNA超らせん)と呼ばれる過程で、ロープのようにねじれることがある。DNAが「弛緩した」状態では、鎖は通常10.4塩基対ごとに二重らせんの軸の周りを一周するが、DNAがねじれると鎖はよりきつく、あるいはより緩く巻かれる[43]。DNAがらせんの方向にねじれている場合、これは正のスーパーコイルと呼ばれ、塩基同士はより近くに配置される。もし反対方向にねじれているなら、これは負のスーパーコイルと呼ばれ、塩基同士はより離れやすくなる。自然界では、ほとんどのDNAは、トポイソメラーゼと呼ばれる酵素によって導入される、わずかに負のスーパーコイルを持っている[44]。これらの酵素は、転写やDNA複製などの過程でDNA鎖に生じるねじれ応力を緩和するためにも必要である[45]。
代替DNA構造

DNAは、A-DNA(A型DNA)、B-DNA(B型DNA)、Z-DNA(Z型DNA)などの多くの起こりうるコンホメーションで存在するが、機能的な生物で直接観察されているのはB-DNAとZ-DNAに限られる[14]。DNAが取るコンホメーションは、水和レベル、DNA配列、スーパーコイルの量と方向、塩基の化学修飾、金属イオンの種類と濃度、溶液中のポリアミンの有無に依存する[46]。
A-DNA、およびB-DNAのX線回折パターンについて最初に発表された報告では、パターソン関数に基づく解析が使用され、DNAの配向繊維に限られた構造情報しか得られなかった[47][48]。1953年、ウィルキンスらによって、高水和DNA繊維の in vivo(生体内)B-DNA X線回折散乱パターンについて、ベッセル関数の2乗という観点から別の解析法が提案された[49]。同じジャーナルで、ジェームズ・ワトソンとフランシス・クリックが、DNAのX線回折パターンの分子モデリング解析を発表し、その構造が二重らせんであることを提案した[9]。
B-DNAは細胞内で見られる条件下で最もありふれているが[50]、これは明確に定義されたコンホメーションではなく、細胞内で見られる高水和レベルで生じる関連するDNAコンホメーションの一群である[51]。それらに対応するX線回折とX線散乱のパターンは、かなりの程度の無秩序を伴う分子準結晶に特徴的である[52][53]。
B-DNAと比較すると、A-DNAは浅く広い副溝と狭く深い主溝を持つ、より幅の広い右巻きらせんである。A型は、非生理学的条件下では、部分的に脱水したDNA試料中に生じるが、細胞内ではDNA鎖とRNA鎖の混成ペアリングや、酵素-DNA複合体に生じることがある[54][55]。塩基がメチル化で化学修飾されたDNAセグメントは、より大きなコンホメーション変化を起こし、Z-DNAを取ることがある。この場合、鎖はらせん軸を中心に左巻きのらせんを描き、より一般的なB型とは正反対となる[56]。このような特異な構造は、特異的なZ-DNA結合タンパク質によって認識され、転写制御に関与している可能性がある[57]。
代替DNA化学
宇宙生物学者たちは長年にわたり、現在知られている生命とは根本的に異なる生化学的および分子学的プロセスを用いる、地球上の微生物生物圏(影の生物圏)の存在を提案してきた。その提案の一つは、DNA中のリンの代わりにヒ素を使用する生命体の存在であった。2010年、GFAJ-1という細菌におけるその可能性が報告されたが[58][59]、この研究は論争を呼び[59][60]、細菌がDNA骨格や他の生体分子へのヒ素の取り込みを積極的に妨げていることを示唆する証拠が示された[61]。
四重鎖構造

線状染色体の末端には、テロメアと呼ばれる特殊なDNA領域がある。テロメアの主な役割は、通常DNAを複製する酵素は染色体の3'末端の端部をコピーできないため、細胞がテロメラーゼという酵素を使用して染色体末端を複製できるようにすることである[63]。これらの特殊な染色体キャップはDNA末端を保護し、細胞のDNA修復系がそれらを修正すべき損傷として扱うことを防ぐのにも役立つ[64]。ヒト細胞ではテロメアは通常、単純な TTAGGG 配列が数千回繰り返された一本鎖DNAである[65]。
これらのグアニンに富んだ配列は他のDNA分子に見られる通常の塩基対ではなく、4塩基単位が積み重なった構造を形成することによって染色体末端を安定化させる可能性がある。ここでは4つのグアニン塩基が、グアニンテトラッド(英: guanine tetrad)と呼ばれる平面を形成している。そして、これらの4塩基単位の平面が積み重なり、安定したグアニン四重鎖構造を形成する[66]。これらの構造は、塩基の端同士の水素結合と、各4塩基単位の中心にある金属イオンのキレート化によって安定化している[67]。他の構造を形成することも可能で、中央にある4塩基の集まりは、塩基の周囲に折りたたまれた単鎖か、それぞれが中央の構造に1塩基ずつ寄与するいくつかの異なる平行鎖のいずれかから形成される。
このような積層構造に加えて、テロメアはテロメアループ(Tループ)と呼ばれる大きなループ構造も形成する。ここでは、一本鎖DNAがテロメア結合タンパク質によって安定化された大きな円を描くように巻きついている[68]。Tループの最先端では一本鎖テロメアDNAがテロメア鎖によって二本鎖DNAの領域に保持され、二重らせんDNAを分離し、二本鎖の一方と塩基対を形成する。この三重鎖構造は、置換ループあるいはDループと呼ばれる[66]。
分岐DNA
DNAでは、相補的であるべき二本鎖DNAの末端部に相補的でない領域が存在すると「ほつれ」を生じる。しかし第三のDNA鎖が導入され、既存の二本鎖のほつれ領域と混成できる隣接領域を含む場合、分岐DNA(英: branched DNA)が生じる可能性がある。分岐DNAの最も単純な例は3本のDNA鎖のみであるが、さらなる鎖と複数の分岐を含む複合体も可能である[69]。分岐DNAは、幾何学的形状を構築するためにナノテクノロジーで使用することができる。以下の技術における用途の節も参照のこと。
人工塩基
いくつかの人工塩基が合成され、ハチモジDNA(英: Hachimoji DNA)と呼ばれる8塩基の核酸アナログに組み込むことに成功した。S、B、P、Zと命名されたこれらの人工塩基は、予測可能な方法で互いに結合し(S-BとP-Z)、DNAの二重らせん構造を維持し、RNAに転写することができる。これらの人工塩基の存在は、地球上で進化してきた4つの天然の核酸塩基には特別なものは何もないことを示すものと考えられる[70][71]。一方、DNAはRNAと密接な関係にあり、RNAはDNAの転写産物としてだけではなく、細胞内で多くの仕事をこなす分子機械でもある。そのためには、RNAは適切な構造に折り畳まれなければならない。すべての可能な立体構造を作るためには、対応するRNAに少なくとも4つの塩基が必要であることが示されている[72]。一方、それ以上の数も可能であるが、これは最小努力の自然原理に反することになる。
酸性度
DNAのリン酸基はリン酸と同様の酸性特性を与えることから、強酸とみなすことができる。DNAは、通常の細胞内pHでは完全にイオン化し、陽子を放出してリン酸基は負電荷を帯びる。これらの負電荷は、DNAを加水分解しうる求核物質をはねつけて、加水分解による分解からDNAを保護する[73]。

巨視的外観
細胞から抽出された純粋なDNAは、白い糸状の凝集塊を形成する[74]。
化学修飾とDNAパッケージングの変化
塩基修飾とDNAパッケージング
遺伝子の発現は、DNAが染色体の中でクロマチンと呼ばれる階層的な構造にどのようにパッケージングされているかに影響される。塩基修飾はパッケージングに関与する可能性があり、遺伝子発現が低いかまったくない領域は通常、シトシン塩基のメチル化が高レベルで見られる。DNAパッケージングとその遺伝子発現への影響は、クロマチン構造においてDNAが巻きついているヒストンタンパク質コアの共有結合修飾や、クロマチン・リモデリング複合体によるリモデリングでも起こりうる。さらに、DNAメチル化とヒストン修飾の間にはクロストークがあるため、クロマチンと遺伝子発現に協調的に影響を与える可能性がある[75]。
たとえば、シトシンのメチル化は5-メチルシトシンを生成し、これはX染色体の不活性化に重要である[76]。メチル化の平均レベルは生物によって異なり、カエノラブディティス・エレガンス(Caenorhabditis elegans)という線虫はシトシンのメチル化を欠くが、脊椎動物はメチル化のレベルが高く、DNAの最大1%が5-メチルシトシンを含む[77]。5-メチルシトシンは重要であるにもかかわらず、脱アミノ化してチミン塩基に変換されることがあるため、メチル化シトシンは特に変異を起こしやすい[78]。その他の塩基修飾としては、細菌におけるアデニンのメチル化、脳における5-ヒドロキシメチルシトシンの存在[79]、およびキネトプラスト類における塩基Jを生成するためのウラシルのグリコシル化などがある[80][81]。
損傷

DNAは、DNA配列を変化させるさまざまな種類の変異原によって損傷を受ける可能性がある。変異原には、酸化剤やアルキル化剤などの化学物質のほか、紫外線やX線などの高エネルギー電磁放射線も含まれる。どのようなDNA損傷が生じるかは変異原の種類によって異なる。たとえば、紫外線はピリミジン塩基間の架橋であるチミン二量体を生成することによって、DNAに損傷を与える可能性がある[83]。一方、フリーラジカルや過酸化水素のような酸化剤は、塩基修飾、特にグアノシンの修飾や、二本鎖切断など、さまざまな形の損傷を引き起こす[84]。典型的なヒト細胞には、酸化的損傷を受けた塩基が約15万個所ある[85]。これらの酸化的損傷のうち最も危険なのは修復が困難な二本鎖切断であり、点変異、DNA配列からの挿入や欠失、あるいは染色体転座を引き起こす可能性がある[86]。これらの変異は癌(がん)を引き起こす可能性がある。DNA修復機構には本質的な限界があるため、人間が長生きすれば、いずれは誰も癌を発症することになる[87][88]。活性酸素種や細胞水の加水分解活性などを産生する正常な細胞プロセスに起因する、自然発生的なDNA損傷も頻繁に起こる。これらの損傷の大部分は修復されるが、どの細胞においても、修復過程の作用にもかかわらず、DNA損傷の一部が残ることがある。これらの残存DNA損傷は、哺乳類の有糸分裂後組織において加齢とともに蓄積する。この蓄積は老化の重要な根本原因であると考えられている[89][90][91]。
変異原の多くは隣接する2つの塩基対の間に侵入し、これはインターカレーション(英: intercalation)と呼ばれる過程である。ほとんどのインターカレーター(侵入物質)は芳香族の平面分子であり、たとえば臭化エチジウム、アクリジン、ダウノルビシン、ドキソルビシンなどである。インターカレーターが塩基対の間に侵入するためには、塩基が離れなければならず、二重らせんがほどけることでDNA鎖に歪みが生じる。これは転写とDNA複製の両方を阻害し、毒性と変異を引き起こす[92]。その結果、DNAインターカレーターは発癌性を生じ、またサリドマイドの場合は催奇形性を生じる可能性がある[93]。また、ベンゾ[a]ピレンジオールエポキシドやアフラトキシンのように、DNA付加体を形成し、複製誤りを引き起こすものもある[94]。それにもかかわらず、DNAの転写や複製を阻害する能力があるため、他の類似毒素も、急速に増殖する癌細胞を阻害する化学療法に使用されている[95]。
生物学的機能

DNAは通常、真核生物では線状染色体として存在し、原核生物では環状染色体として存在する。細胞内の染色体の集合がゲノムを構成し、ヒトゲノムでは46本の染色体に約30億塩基対のDNAが配置されている[96]。DNAが伝達する情報は、遺伝子と呼ばれるDNA断片の配列に含まれている。遺伝子による遺伝情報の伝達すなわち遺伝は、相補的な塩基対形成によって達成される。たとえば、転写において細胞が遺伝子の情報を使用する際、DNAと正しいRNAヌクレオチドとの間に引力が作用することで、DNA配列が相補的なRNA配列に複製される。通常、翻訳と呼ばれる過程で、このRNAコピーは一致するタンパク質配列を作るために使用されるが、これもRNAヌクレオチド間の同様な相互作用に依存している。あるいは、細胞はDNA複製と呼ばれる過程で、その遺伝情報を複製することができる。これらの機能の詳細については他の記事で取り上げており、ここではゲノムの機能を仲介するDNAと他の分子との相互作用に焦点を当てる。
遺伝子とゲノム
ゲノムDNAは、DNA凝縮と呼ばれる過程を通じて、細胞の小さな体積に収まるようにきつく整然と詰め込まれている。真核生物の場合、DNAは細胞核に存在し、ミトコンドリアや葉緑体にも少量が存在する。原核生物では、DNAは核様体(ヌクレオイド)と呼ばれる細胞質内の不規則な形をした構造体に保持されている[97]。ゲノムの遺伝情報は遺伝子内に保持されており、生物におけるこの情報の完全な集合をその遺伝型(英: genotype)と呼ぶ。遺伝子は遺伝の単位であり、生物の特定の形質に影響を与えるDNAの領域である。遺伝子には、転写可能なオープンリーディングフレームと、オープンリーディングフレームの転写を制御するプロモーターやエンハンサーなどの制御配列が含まれている。
多くの生物種では、ゲノム配列全体のごく一部のみタンパク質をコードしている。たとえば、ヒトゲノムのうちタンパク質をコードするエクソンはわずか約1.5%しかなく、ヒトDNAの50%以上は非コード反復配列で構成されている[98]。真核生物のゲノムに非常に多くの非コードDNAが存在する理由と、ゲノムの大きさ(C値)が生物種によって著しく異なる理由は、「C値の謎」として知られる長年の難問である[99]。しかし、タンパク質をコードしないDNA配列の中には、遺伝子発現の調節に関与する機能的な非コードRNA分子をコードしているものもある[100]。

非コードDNA配列の中には染色体の構造的役割を果たすものがある。テロメアとセントロメアには通常、ほとんど遺伝子が存在しないが、染色体の機能と安定性にとって重要である[64][102]。ヒトに多く存在する非コードDNAは偽遺伝子であり、変異によって機能しなくなった遺伝子の複製である[103]。これらの配列は、遺伝子の重複や分岐の過程を通じて、新しい遺伝子を生み出すための遺伝物質の原料として役に立つこともあるが、通常は単なる分子の遺物である[104]。
転写と翻訳
遺伝子は遺伝情報を含むDNA配列で、生物の表現型に影響を与えることがある。遺伝子内では、DNA鎖に沿った塩基配列がメッセンジャーRNA配列を規定し、それが1つか複数のタンパク質配列を規定する。遺伝子のヌクレオチド配列とタンパク質のアミノ酸配列との関係は、遺伝暗号と総称される翻訳規則によって決定される。遺伝暗号は、コドン(codon)と呼ばれる3文字の「単語」からなり(例:ACT、CAG、TTT)、ヌクレオチドが3個連続した配列に基づいている。
転写の際、遺伝子のコドンがRNAポリメラーゼによってメッセンジャーRNAにコピーされる。次に、このRNAコピーはリボソームによって解読され、リボソームはメッセンジャーRNAをアミノ酸を運ぶトランスファーRNAに塩基対合させることによってRNA配列を読み取る。4種類の塩基を表す3文字が組み合わさって、64通りのコドンの可能性が存在する(43 通りの組み合わせ)。これらのコドンは20種類の標準アミノ酸をコードしており、ほとんどのアミノ酸は複数のコドンに対応付けられる。また、コード領域の終わりを示す3つの「終止コドン」(ナンセンスコドンとも呼ばれる)もある。これらは、TAG、TAA、TGAコドンである(mRNAではUAG、UAA、UGA)。

複製
細胞分裂は生物が成長するために不可欠であるが、細胞が分裂する際には、2つの娘細胞が親と同じ遺伝情報を持つように、ゲノム中のDNAを複製しなければならない。DNAの二本鎖構造はDNA複製の単純な機構を提供する。ここでは二本鎖が分離され、次にDNAポリメラーゼと呼ばれる酵素によってそれぞれの鎖の相補的DNA配列が再作成される。この酵素は、相補的塩基対の形成を通じて正しい塩基を見つけ、それを元の鎖に結合させることで相補鎖を作成する。DNAポリメラーゼはDNA鎖を5'から3'の方向にしか伸長できないため、二重らせんの逆平行鎖を複製するために異なる機構が使われる[105]。このようにして、古い鎖の塩基が新しい鎖の塩基を決定し、細胞はそのDNAの完全な複製を得ることができる。
細胞外核酸
裸の細胞外DNA(英: extracellular DNA、eDNA)は、そのほとんどが細胞死の際に放出されたもので、環境中にほぼ遍在している。土壌中の濃度は2 μg/Lと高く、自然の水性環境中では88 μg/Lに達することもある[106]。eDNAの働きとして、遺伝子の水平伝播への関与[107]、栄養素の供給[108]、あるいはイオンや抗生物質を取り込んだり用量を調整するための緩衝剤としての機能など、さまざまな可能性が提案されている[109]。eDNAは、いくつかの細菌種のバイオフィルムにおいて、機能的な細胞外マトリックス成分として機能する。eDNAの働きには、バイオフィルム内の特定の細胞型の付着と分散を制御する認識因子として働く可能性や[110]、バイオフィルム形成に寄与する可能性[111]、あるいはバイオフィルムの物理的強度と生物学的ストレスに対する抵抗性に寄与する可能性がある[112]。
無細胞胎児DNAは母体の血液中に存在し、その塩基配列を決定することで発達中の胎児に関する多くの情報を得ることができる[113]。
環境DNAとして知られるeDNAは、水中、大気中、陸上における生物種の動きと存在を監視し、その地域の生物多様性を評価する生態学の調査ツールとして、自然科学の分野で利用が拡大している[114][115]。
好中球細胞外トラップ
好中球細胞外トラップ(英: neutrophil extracellular trap、NET)は、主にDNAから構成される細胞外繊維のネットワークであり、白血球の一種である好中球が宿主細胞への損傷を最小限に抑えながら細胞外の病原体を殺滅することを可能にする。
タンパク質との相互作用
DNAの機能はすべてタンパク質との相互作用に依存している。これらのタンパク質相互作用は非特異的であることもあれば、タンパク質が単一のDNA配列に特異的に結合することもある。酵素もDNAに結合することができ、その中でも特に重要なものは、転写とDNA複製の際にDNA塩基配列をコピーするポリメラーゼである。
DNA結合タンパク質

DNAと結合する構造タンパク質は、非特異的DNA-タンパク質相互作用の例としてよく理解されている。染色体内でDNAは構造タンパク質と複合体を形成して保持されている。これらのタンパク質はDNAをクロマチン(染色質)と呼ばれる緻密な構造に組織化する。真核生物では、この構造はヒストンという小さな塩基性タンパク質の複合体にDNAが結合したものであるが、原核生物では複数種類のタンパク質が関与している[116][117]。ヒストンはヌクレオソームと呼ばれる円盤状の複合体を形成し、その表面には二本鎖DNAが2周完全に巻きついている。これらの非特異的相互作用は、ヒストンの塩基性残基がDNAの酸性糖-リン酸骨格とイオン結合を形成することによって生じるもので、したがって、塩基配列とはほとんど無関係である[118]。これらの塩基性アミノ酸残基の化学修飾には、メチル化、リン酸化、アセチル化などがある[119]。これらの化学的変化はDNAとヒストン間の相互作用の強度を変化させ、DNAを転写因子に近づきやすくしたり、あるいは近づきにくくし、転写速度を変化させる[120]。クロマチン内の他の非特異的DNA結合タンパク質には、曲がったDNAや歪んだDNAに結合する高移動度郡タンパク質がある[121]。これらのタンパク質は、ヌクレオソームの配列を曲げたり、染色体を構成する大きな構造体を組み立てる際に重要である[122]。
DNA結合タンパク質のもう一つのグループとして、一本鎖DNAと特異的に結合するDNA結合タンパク質がある。ヒトの場合、複製タンパク質Aがこの一群の中で最もよく理解されており、DNA複製、組換え、DNA修復など、二重らせんが分離するプロセスに関与している[123]。これらの結合タンパク質は一本鎖DNAを安定化させ、ステムループを形成したり、ヌクレアーゼによる分解からDNAを保護していると考えられている。

対照的に、他のタンパク質は特定のDNA配列に結合するような進化をしてきた。最も研究が進んでいるのは、転写を制御するタンパク質であるさまざまな転写因子である。各転写因子はプロモーター近くの特定のDNA配列に結合し、遺伝子の転写を活性化または阻害する。転写因子は2つの方法でこれを行う。一つは、転写を担うRNAポリメラーゼに直接、あるいは他の媒介タンパク質を介して結合することである。これによって、ポリメラーゼはプロモーターに位置し、転写を開始することができる[125]。あるいは、転写因子はプロモーターのヒストンを修飾する酵素と結合することができる。これによってDNA鋳型に対するポリメラーゼの近づきやすさを変化させる[126]。
これらのDNA標的は生物のゲノム全体に存在する可能性があるため、一種類の転写因子の活性が変化すると、何千もの遺伝子に影響を及ぼす可能性がある[127]。その結果、これらのタンパク質はしばしば、環境変化への応答や細胞の分化・発達を制御するシグナル伝達プロセスの標的となる。これらの転写因子のDNAとの相互作用の特異性は、タンパク質がDNA塩基の端と何度も接触して、DNA配列を「読み取る」ことを可能にすることで生じる。これらの塩基相互作用のほとんどは塩基が最も接近しやすい主溝で起こる[25]。

DNA修飾酵素
ヌクレアーゼとリガーゼ
ヌクレアーゼは、ホスホジエステル結合の加水分解を触媒することによってDNA鎖を切断する酵素である。DNA鎖の末端からヌクレオチドを加水分解するヌクレアーゼはエキソヌクレアーゼと呼ばれ、一方エンドヌクレアーゼは鎖内で切断する。分子生物学で最もよく使用されるヌクレアーゼは、特異的配列でDNAを切断する制限エンドヌクレアーゼである。たとえば、上図に示したEcoRV酵素は、DNA鎖の6塩基配列 5′-GATATC-3′ を認識し、水平線で切断する。自然界でこれらの酵素は、制限修飾系の一部として細菌の細胞内に侵入したファージDNAを消化することにより、細菌をファージ感染から保護している[129]。技術分野では、これらの配列特異的ヌクレアーゼは分子クローニングやDNAプロファイリングに使用されている。
DNAリガーゼと呼ばれる酵素は、切断または破損したDNA鎖を再結合させることができる[130]。リガーゼは、ラギング鎖DNA複製において特に重要で、複製フォークで作られた短いDNAセグメントをDNA鋳型の完全なコピーに結合する働きをする。これらはまたDNA修復や遺伝的組換えにも使用される[130]。
トポイソメラーゼとヘリカーゼ
トポイソメラーゼはヌクレアーゼとリガーゼの両方の活性を持つ酵素である。これらのタンパク質はDNAスーパーコイルの量を変化させる。これらの酵素の中には、DNAらせんを切断し、その一部分を回転させることでスーパーコイルのひずみを低減させ、その後DNAの切断部を封着するものもある[44]。別の種類の酵素は、DNAらせんを切断し、その切断部分に2本目のDNAを通過させてから、らせんを再結合することができる[131]。このようにトポイソメラーゼは、DNA複製や転写など、DNAが関与する多くの過程に必要な酵素である[45]。
ヘリカーゼは分子モーターとして働くタンパク質である。これらは、ヌクレオシド三リン酸、主にアデノシン三リン酸(ATP)の化学エネルギーを利用して、塩基間の水素結合を切断し、DNA二重らせんをほどいて一本鎖にする[132]。これらの酵素は、酵素がDNA塩基に近接する必要があるほとんどの過程にとって不可欠である。
ポリメラーゼ
ポリメラーゼはヌクレオシド三リン酸からポリヌクレオチド鎖を合成する酵素である。その生成物の配列は、鋳型(英: template)と呼ばれる既存のポリヌクレオチド鎖に基づいて作られる。これらの酵素は、伸長するポリヌクレオチド鎖末端の3'ヒドロキシ基に繰り返しヌクレオチドを付加する機能を持つ。結果としてすべてのポリメラーゼは5'から3'の方向に働く[133]。これらの酵素の活性部位では、入ってきたヌクレオシド三リン酸が鋳型と塩基対を形成する。これにより、ポリメラーゼは鋳型の相補鎖を正確に合成することができる。ポリメラーゼは、使用する鋳型の種類によって分類される。
DNA複製は、DNA依存性DNAポリメラーゼがDNAポリヌクレオチド鎖のコピーを作る。生物学的情報を保存するためには、各コピーの塩基配列が鋳型鎖の塩基配列と正確に相補的であることが不可欠である。多くのDNAポリメラーゼは校正活性を持っている。これによりポリメラーゼは、ミスマッチしたヌクレオチド間での塩基対形成の欠如によって、合成反応の際にときおり起こる誤りを検出することができる。ミスマッチが検出されると、3'→5'エキソヌクレアーゼ活性が活性化され、誤った塩基が除去される[134]。ほとんどの生物でDNAポリメラーゼは、DNAクランプやヘリカーゼなどの複数のアクセサリー・サブユニットを含む、レプリソームと呼ばれる大きな複合体の中で機能する[135]。
RNA依存性DNAポリメラーゼは、RNA鎖の塩基配列をDNAにコピーする特殊なポリメラーゼである。これらには、レトロウイルスによる細胞感染に関与するウイルス性酵素である逆転写酵素や、テロメアの複製に必要なテロメラーゼが含まれる[63][136]。たとえば、HIV逆転写酵素は、エイズウイルスの複製に関与する酵素である[136]。テロメラーゼは、その構造の一部として自身のRNA鋳型を含むという珍しいポリメラーゼである。これは染色体の末端にテロメアを合成する。テロメアは隣接する染色体末端が融合するのを防ぎ、染色体末端を損傷から保護する[64]。
転写は、DNA鎖の配列をRNAにコピーするDNA依存性RNAポリメラーゼによって行われる。遺伝子の転写を開始するために、RNAポリメラーゼはプロモーターと呼ばれるDNA配列に結合し、DNA鎖を分離する。その後、ターミネーターと呼ばれるDNAの領域に到達するまで、遺伝子配列をメッセンジャーRNA転写物にコピーし、そこで停止してDNAから分離する。ヒトのDNA依存性DNAポリメラーゼと同様に、ヒトゲノムのほとんどの遺伝子を転写する酵素であるRNAポリメラーゼIIは、いくつか調節サブユニットとアクセサリーサブユニットを持つ大きなタンパク質複合体の一部として働いている[137]。
遺伝子組換え
 |
 |
| 遺伝的組換えにおけるホリデイジャンクション中間体の構造。4本のDNA鎖は、赤、青、緑、黄に色分けされている[138] | |

DNAらせんは通常、他のDNAセグメントと相互作用することはなく、ヒトの細胞では、異なる染色体は染色体テリトリー(英: chromosome territories)と呼ばれる核内の別々の領域を占めることさえある[139]。このように異なる染色体が物理的に分離していることは、DNAが安定した情報保管場所として機能するために重要である。なぜなら、染色体が相互作用する数少ない機会のひとつが、有性生殖の際に起こる染色体交差(英: chromosomal crossover)であり、その際に遺伝的組換えが起こるからである。染色体交差とは、DNAの2本のらせんが切断され、一部が入れ替わり、再び結合することである。
組換えは、染色体が遺伝情報を交換して遺伝子の新しい組み合わせを作り出すことを可能にし、これにより自然選択の効率を高め、新しいタンパク質の急速な進化において重要である[140]。遺伝的組換えはDNA修復、特に二本鎖切断に対する細胞の反応にも関与している可能性がある[141]。
染色体交差の最も一般的な形態は相同組換えで、関与する2つの染色体の配列は非常によく似ている。非相同組換えは、染色体転座や遺伝的異常を生じさせるため、細胞に損傷を与える可能性がある。組換え反応は、RAD51のようなリコンビナーゼとして知られる酵素によって触媒される[142]。組換えの最初の段階は、エンドヌクレアーゼかDNAの損傷によって引き起こされる二本鎖切断である[143]。その後、リコンビナーゼによって部分的に触媒される一連の段階によって、2つのらせんは少なくとも1つのホリデイジャンクションによって結合され、次に、各らせん中の一本鎖セグメントが他方のらせんの相補鎖と二本鎖を形成する。ホリデイジャンクションは四面体の接合構造で、染色体対に沿って移動することができ、一方の鎖をもう一方の鎖と交換することができる。組換え反応は、結合部の切断と遊離したDNAの再結合によって停止する[144]。組換えの際に同じ方向性(極性)の鎖だけがDNAを交換する。切断には東西切断(east-west cleavage)と南北切断(north–south cleavage)の2種類がある。南北切断はDNAの両鎖を切断するが、東西切断はDNAの片鎖をそのまま残す。組換えの際にホリデイジャンクションが形成されることで、遺伝的多様性、染色体上での遺伝子の交換、および野生型ウイルスゲノムの発現が可能になる。
進化
DNAにはあらゆる生命体が機能し、成長し、生殖するための遺伝情報が含まれている。しかし40億年の生命の歴史の中で、DNAがいつからこの機能を果たしてきたかは不明である。最も初期の生命体はRNAを遺伝物質として使っていたのではないかという提案もある[145][146]。RNAは遺伝情報の伝達とリボザイムの一部としての触媒作用の両方を行うことができるため、初期の細胞代謝において中心的な役割を果たしていた可能性がある[147]。核酸が触媒作用と遺伝学の両方に使われていたとする、この古代のRNAワールドは、4塩基に基づく現在の遺伝暗号の進化に影響を与えたかもしれない。このような生物における異なる塩基の数は、少ない塩基数による複製精度の向上と、多数の塩基によるリボザイムの触媒効率の向上との釣り合い関係によってきまった可能性もある[148]。しかしDNAは環境中で100万年未満しか存在できず、溶液中でゆっくりと短い断片に分解されるため、ほとんどの化石からDNAを回収することは不可能で、古代の遺伝子系の直接的な証拠はない[149]。より古いDNAが存在するという主張もなされており、特に2億5千万年前の塩の結晶から生存可能な細菌が分離されたという報告があるが[150]、これらの主張には賛否がある[151][152]。
DNAの構成要素(アデニン、グアニン、および関連する有機分子)は、地球外の宇宙空間で形成された可能性もある[153][154][155]。ウラシル、シトシン、チミンを含む、生命の複雑なDNAやRNAの有機化合物もまた、隕石から発見されたピリミジンのような化学物質を出発点として、宇宙空間の模倣した条件下の実験室で合成されている。ピリミジンは、宇宙で発見された最も炭素を多く含む化学物質である多環芳香族炭化水素(PAH)と同様、赤色巨星や星間宇宙塵やガス雲で形成された可能性がある[156]。
2021年2月、科学者たちは初めて、100万年以上前のマンモス象の遺体からDNA配列を決定したことを報告した。これまでに塩基配列が決定された最古のDNAである[157][158]。
技術における用途
遺伝子工学
フェノール・クロロホルム抽出法のように、生物からDNAを精製する方法や、制限消化やポリメラーゼ連鎖反応のように実験室でDNAを操作する方法が開発された。現代の生物学や生化学では、組換えDNAの分野でこれらの技術を活用している。組換えDNAとは、他のDNA配列から組み立てられた人工のDNA配列である。これらはウイルスベクターを利用して、プラスミドあるいは他の適切な型式で、生物に形質転換することができる[159]。生産された遺伝子組換え生物は、組換えタンパク質のような製品を製造したり、医学研究で使用したり[160]、農業で繁殖したりする[161][162]。
DNAプロファイリング
法科学者は、犯罪現場で発見された血液、精液、皮膚、唾液、または毛髪に含まれるDNAを利用して、加害者などの個人と一致するDNAを特定することができる[163]。この手法は正式にはDNAプロファイリング(英: DNA profiling)と呼ばれ、DNA指紋法(英: DNA fingerprinting)とも呼ばれる。DNAプロファイリングでは、ショートタンデムリピート(縦列型反復配列)やミニサテライトなど、反復DNAの可変部分の長さを個人間で比較する。この方法は通常、一致するDNAを同定するための非常に信頼性の高い技術である[164]。ただし、現場が複数名のDNAで汚染されている場合、同定が複雑になることがある[165]。DNAプロファイリングは1984年にイギリスの遺伝学者アレック・ジェフリーズによって開発され[166]、1988年のエンダービー殺人事件でコリン・ピッチフォークを有罪にするために法科学で初めて使用された[167]。
法科学が発達し、血液、皮膚、唾液、毛髪などの微量サンプルで遺伝子照合ができるようになったことで、多くの事件が再調査されるようになった。当初の調査時には科学的に不可能であった証拠も、現在では発見されることがある。一部の地域において二重の危険の原則(英: double jeopardy law)が撤廃されたこともあいまって、これまでの裁判で陪審を納得させるに十分な証拠が得られなかった事件でも再審が可能になることがある。重大犯罪で起訴された人々は、照合目的でDNAサンプルの提出を求められることがある。法科学的に得られたDNA照合に対する最も明白な抗弁は、証拠の相互汚染が起こったと主張することである。このため、重大犯罪の新事例に対し、細心の注意を払った厳格な取り扱い手順が導入されるようになった。
DNAプロファイリングはまた、集団死傷事件の犠牲者[168]、重大事故の遺体やその一部、集団戦没者墓地における犠牲者個人の身元を、家族との照合によって確認するためにも使用され、成功を収めている。
DNAプロファイリングは、誰かが子供の生みの親または祖父母であるかどうかを判定するためのDNA親子鑑定にも使用され、親とされる人物が子供と生物学的に血縁関係がある場合、親である確率は通常99.99%である。通常のDNA配列決定法は出生後に行われるが、母親がまだ妊娠している間に親子関係を検査する新しい方法がある[169]。
DNA酵素または触媒DNA
デオキシリボザイム(英: deoxyribozyme)は、DNA酵素(DNAzymes)または触媒DNA(catalytic DNA)とも呼ばれ、1994年に初めて発見された[170]。これらの大部分は、in vitro選択法または試験管内進化法(英: Systematic Evolution of Ligands by Exponential Enrichment、SELEX)と呼ばれる組み合わせアプローチを使用して、ランダムなDNA配列の大規模プールから単離された一本鎖DNA配列である。DNA酵素は、RNA-DNA切断、RNA-DNAライゲーション、アミノ酸のリン酸化-脱リン酸化、炭素-炭素結合形成など、さまざまな化学反応を触媒する。DNA酵素は、触媒反応の化学反応速度を、無触媒反応の最大1千億倍に向上させることができる[171]。DNA酵素の中でもっとも広く研究されているのはRNA切断型で、さまざまな金属イオンの検出や治療薬の設計に使用されている。GR-5 DNA酵素(鉛特異的)[170]、CA1-3 DNA酵素(銅特異的)[172]、39E DNA酵素(ウラニル特異的)、NaA43 DNA酵素(ナトリウム特異的)[173]など、いくつかの金属特異的DNA酵素が報告されている。NaA43 DNA酵素は、ナトリウムに対して他の金属イオンよりも10,000倍以上選択的であると報告されており、細胞内でリアルタイムのナトリウムセンサーを作成するために使用された。
バイオインフォマティクス
バイオインフォマティクスは、DNA核酸配列データを含む生物学的データの保存、データマイニング、検索、操作のための技術開発を含む学問分野である。これらの技術は、コンピュータサイエンス、特に文字列検索アルゴリズム、機械学習、データベース理論に広く応用されるようになった[174]。文字列検索またはマッチングアルゴリズムは、より大きな文字列の中にある文字列の出現を検出する手法で、ヌクレオチドの特異的配列を検索するために開発された[175]。DNA配列を他のDNA配列と整列させることで、相同配列を同定し、それらを区別する特異的変異を突き止めることができる。これらの技術、特に多重配列アラインメントは、系統的関係やタンパク質機能を研究する際に使用される[176]。ヒトゲノムプロジェクトで作成されたような全ゲノムDNA配列の大規模なデータセットは、各染色体上の遺伝子や調節エレメントの位置を特定するアノテーションがなくては利用が困難である。タンパク質やRNAをコードする遺伝子に関連する特徴的なパターンを持つDNA配列領域は、遺伝子探索アルゴリズムによって同定することができ、これにより研究者は、特定の遺伝子産物が実験的に単離される前であっても、生物内での存在と可能性のある機能を予測することができる[177]。また、ゲノム全体を比較することで、生物の進化の歴史に焦点を当てたり、複雑な進化の過程を研究することもできる。
DNAナノテクノロジー

DNAナノテクノロジーは、DNAや他の核酸に特有の分子認識特性を利用して、有用な特性を備えた自己集合化能・分岐DNA複合体を作り出す技術領域である[179]。DNAは生物学的情報の伝達手段としてではなく、構造材料として使用することもできる。その結果、2次元周期格子(タイルベースとDNAオリガミ法の両方)や、多面体形状を持つ3次元構造の創造につながった[180]。ナノメカニカルデバイスやアルゴリズム的自己集合化も実証されており[181]、これらのDNA構造は、金ナノ粒子やストレプトアビジンタンパク質など、他の分子集合体の鋳型とするために使用されている[182]。DNAや他の核酸は、アプタマー(さまざまなバイオテクノロジーや生物医学の用途に使われる、特定の標的分子に対する合成オリゴヌクレオチドリガンド)の基礎となっている[183]。
系統学と人類学
DNAは時間の経過とともに変異を蓄積し、遺伝によって歴史的な情報を含んでおり、DNAの塩基配列を比較することで、遺伝学者は生物の進化の歴史、系統発生を推定することができる[184]。系統発生学は進化生物学における強力な道具である。生物種内のDNA配列を比較することで、集団遺伝学者は特定の集団の歴史を知ることができる。これは、生態遺伝学から人類学に至るまで、さまざまな研究に利用できる。
情報ストレージ
情報記録媒体としてのDNAは、電子機器に比べて記録密度がはるかに高いため、非常に大きな可能性を秘めている。しかしコストが高く、読み書きに時間がかかり(メモリレイテンシ)、信頼性が十分でないことなどから、実用化には至っていない[185][186]。
歴史


DNAが最初に単離されたのは、1869年、スイスの医師フリードリッヒ・ミーシェルによって、廃棄された手術用包帯の膿(うみ)の中から微小な物質を発見した時にさかのぼる。細胞核に存在することから、彼はこれを「ヌクレイン(英: nuclein)」と命名した[187][188]。1878年、アルブレヒト・コッセルが「ヌクレイン」の非タンパク質成分である核酸を単離し、その後、5つの標準核酸塩基を単離した[189][190]。
1909年、フィーバス・レヴィーンはRNA(当時は「酵母核酸(英: yeast nucleic acid)」と呼んだ)の塩基、糖、リン酸のヌクレオチド単位を同定した[191][192][193]。1929年、レヴィーンはDNA(当時は「胸腺核酸(英: thymus nucleic acid)」)内のデオキシリボース糖を同定した[194]。レヴィーンは、DNAはリン酸基によって結合された4つのヌクレオチド単位からなる紐で構成されていることを提案した(テトラヌクレオチド仮説)。レヴィーンは、この鎖は短く、塩基が一定の順序で繰り返されていると考えた。1927年、ニコライ・コルツォフは、遺伝形質は「それぞれの鎖を鋳型として半保存的に複製される2本の鏡像鎖」からなる「巨大な遺伝分子」を介して遺伝すると提案した[195][196]。1928年、フレデリック・グリフィスは実験によって、肺炎球菌(Pneumococcus)のS型菌の形質が、死滅したS型菌と生きたR型菌とを混合することによって、R型菌に転換できることを発見した(グリフィスの実験)[197][198]。この実験系は、DNAが遺伝情報を伝達していることを初めて明確に示唆した。
1933年、ウニの未受精卵を研究していたジャン・ブラッシェ(Jean Brachet)は、DNAは細胞核に存在し、RNAは細胞質にのみ存在することを提案した。当時は、酵母核酸(RNA)は植物だけに、胸腺核酸(DNA)は動物だけに存在すると考えられていた。後者は細胞内pHを緩衝する機能を持つ四量体であると考えられていた[199][200]。
1937年、ウィリアム・アストベリーは、DNAが規則正しい構造を持っていることを示すX線回折パターンを初めて作成した[201]。
1943年、オズワルド・アベリーは、共同研究者であるコリン・マクロード、マクリン・マッカーティとともに、DNAが形質転換原理であることを突き止め、グリフィスの提案を支持した(アベリー-マクロード-マッカーティの実験)[202]。エルヴィン・シャルガフは、現在「シャルガフの法則」として知られる見解を発表し、どの生物種のDNAにおいても、グアニンの量はシトシンと等しく、アデニンの量はチミンと等しくなければならないと述べた[203][204]。

1951年末、フランシス・クリックは、英国ケンブリッジ大学のキャヴェンディッシュ研究所でジェームズ・ワトソンとともに研究を始めた。遺伝におけるDNAの役割は、1952年にアルフレッド・ハーシーとマーサ・チェイスが行った一連の実験(ハーシー-チェイス実験)で、DNAが腸内細菌ファージT2の遺伝物質であることを示して確認された[205]。
1952年5月、ロザリンド・フランクリンの指導下で研究をしていた大学院生、レイモンド・ゴスリングは、高水和レベルでのDNA X線回折像を撮影し、「Photo 51」とラベルを付けた[206]。この写真は、モーリス・ウィルキンスからワトソンとクリックに渡されたもので、彼らがDNAの正しい構造を得る上で極めて重要なものであった。フランクリンはクリックとワトソンに、主鎖は外側になければならないと語った。それまでは、ライナス・ポーリングや、ワトソンとクリックらは、鎖が内側にあって塩基が外側を向いた誤ったモデルを持っていた。フランクリンがDNA結晶の空間群を特定したことで、クリックは、DNAの二本鎖が逆平行であることを突き止めた[207]。1953年2月、ライナス・ポーリングとロバート・コリーは、リン酸が軸の近くにあり、塩基が外側にある、3本の鎖が絡み合った核酸のモデルを提案した。ワトソンとクリックはそのモデルを完成させ、現在ではDNA二重らせんの最初の正しいモデルとして受け入れられている[208]。1953年2月28日、クリックは、英国ケンブリッジのザ・イーグルパブで常連客のランチタイムを中断し、彼とワトソンが「生命の秘密を発見した」と発表した[209]。
1953年4月25日、雑誌「Nature」は、ワトソンとクリックの二重らせん構造DNAとそれを支持する証拠を示す一連の5本の論文を掲載した[210]。その構造は、『MOLECULAR STRUCTURE OF NUCLEIC ACIDS A Structure for Deoxyribose Nucleic Acid(核酸の分子構造: デオキシリボース核酸の構造)』と題されたレターで報告され、その中で彼らは次のように述べている。『私たちが仮定した特異的な対形成が、遺伝物質の複製メカニズムである可能性を即座に示唆していることを、私たちは見逃さなかった[9]』。この後、フランクリンとゴスリングのレターが続き、彼ら自身のX線回折データと独自の解析方法が初めて公表された[48][211]。さらに、ウィルキンスと彼の同僚2名によるレターが続き、生体内におけるB-DNA X線パターンの解析が報告されており、生体内にワトソンとクリックの構造が存在することを裏付けていた[49]。
1962年、フランクリンの死後、ワトソン、クリック、ウィルキンスの3名はノーベル生理学・医学賞を共同受賞した[212]。ノーベル賞は存命中の受賞者にのみ授与される。2023年4月、科学者たちは新たな証拠に基づき、ロザリンド・フランクリンはDNA発見の過程に貢献しただけでなく「対等な役割」を果たした人物であり、発見後に発表されたような貢献者ではないと結論づけた[213][214][215]。誰がこの発見の功績を称えられるべきかについては議論が続いている[216]。
1957年に行われた影響力のある講演で、クリックは、分子生物学におけるセントラル・ドグマを打ち出し、DNA、RNA、タンパク質の関係を予言し、「アダプター仮説」を公にした[217]。二重らせん構造が示唆する複製機構の最終確認は、1958年のメセルソン-スタールの実験によってなされた[218]。クリックと共同研究者らによる更なる研究によって、遺伝暗号がコドンと呼ばれる塩基の非重複トリプレット(三連符)に基づいていることが明らかにされ、ハー・ゴビンド・コラナ、ロバート・W・ホリー、マーシャル・ニーレンバーグによって遺伝暗号の解読が可能となった[219]。分子生物学の誕生は、これらの発見が基礎となった[220]。
1986年、英国の警察がレスター大学のアレック・ジェフリーズに強姦殺人に関する容疑者の自白の検証または反証を依頼したとき、DNA鑑定は初めて犯罪捜査に利用された。この特別な事件では、容疑者は2件の強姦殺人を自白していたが、後に自白を撤回した。大学の研究所でのDNA鑑定によって、容疑者の当初の「自白」の真実性はすぐに否定され、容疑者は強姦殺人の容疑を晴らすことができた[221]。
符号位置
| 記号 | Unicode | JIS X 0213 | 文字参照 | 名称 |
|---|---|---|---|---|
| 🧬 | U+1F9EC |
- |
🧬🧬 |
dna |
参照項目
- 常染色体 - 性染色体以外の染色体
- 結晶学 - 結晶性固体中の原子の配列を決定する科学的研究
- 全米DNAの日 - 4月25日に祝われるアメリカ合衆国の祝日
- DNAマイクロアレイ - 固体表面に付着した微細なDNAスポットの集合体
- DNAシークエンシング - 核酸配列を決定する工程
- 遺伝子疾患 - ゲノムの1つまたは複数の異常によって引き起こされる健康問題
- 遺伝子系図 - DNA検査によって推定した個人間の遺伝的関係
- ハプロタイプ - 親から受け継いだ遺伝子の集合
- 減数分裂 - 単数体の配偶子を作る細胞分裂の様式
- 核酸表記法 - DNAの4つのヌクレオチドをA、C、G、Tと呼ぶ国際共通表記法
- 塩基配列 - 核酸中のヌクレオチドの連続物
- リボソームDNA - リボソームRNAをコーディングするDNAの特定の領域
- サザンブロット - DNA配列の検出と定量に用いられる分析技術
- X線回折法 - X線ビームの散乱強度に基づく非破壊分析技術の一群
- ゼノ核酸 - 合成核酸アナログ
- 三本鎖DNA - 3本のオリゴヌクレオチドが三重らせんを形成するDNA構造
脚注
- ^ “deoxyribonucleic acid”. Merriam-Webster Dictionary (英語). 2023年12月13日閲覧.
- ^
Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2014年). Molecular Biology of the Cell (6th ed.). Garland. p. Chapter 4: DNA, Chromosomes and Genomes. ISBN 978-0-8153-4432-2. 2014年7月14日時点のオリジナルよりアーカイブ.
{{cite book2}}: CS1メンテナンス: 複数の名前/author (カテゴリ) - ^ Purcell A. “DNA”. Basic Biology. 2017年1月5日時点のオリジナルよりアーカイブ。2015年7月28日閲覧。
- ^ “Uracil” (英語). Genome.gov. 2019年11月21日閲覧。
- ^ Russell P (2001年). iGenetics. New York: Benjamin Cummings. ISBN 0-8053-4553-1.
- ^ Saenger W (1984). Principles of Nucleic Acid Structure. New York: Springer-Verlag. ISBN 0-387-90762-9
- ^ a b Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Peter W (2002). Molecular Biology of the Cell (Fourth ed.). New York and London: Garland Science. ISBN 0-8153-3218-1. OCLC 145080076. オリジナルの1 November 2016時点におけるアーカイブ。
- ^ Irobalieva RN, Fogg JM, Catanese DJ, Catanese DJ, Sutthibutpong T, Chen M, Barker AK, Ludtke SJ, Harris SA, Schmid MF, Chiu W, Zechiedrich L (October 2015). “Structural diversity of supercoiled DNA”. Nature Communications 6: 8440. Bibcode: 2015NatCo...6.8440I. doi:10.1038/ncomms9440. ISSN 2041-1723. PMC 4608029. PMID 26455586.
- ^ a b c d Watson JD, Crick FH (April 1953). “Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid”. Nature 171 (4356): 737–38. Bibcode: 1953Natur.171..737W. doi:10.1038/171737a0. ISSN 0028-0836. PMID 13054692. オリジナルの4 February 2007時点におけるアーカイブ。.
- ^ Mandelkern M, Elias JG, Eden D, Crothers DM (October 1981). “The dimensions of DNA in solution”. Journal of Molecular Biology 152 (1): 153–61. doi:10.1016/0022-2836(81)90099-1. ISSN 0022-2836. PMID 7338906.
- ^ Arrighi, Frances E.; Mandel, Manley; Bergendahl, Janet; Hsu, T. C. (June 1970). “Buoyant densities of DNA of mammals”. Biochemical Genetics 4 (3): 367–376. doi:10.1007/BF00485753.
- ^ a b c d Berg J, Tymoczko J, Stryer L (2002). Biochemistry. W.H. Freeman and Company. ISBN 0-7167-4955-6
- ^ IUPAC-IUB Commission on Biochemical Nomenclature (CBN) (December 1970). “Abbreviations and Symbols for Nucleic Acids, Polynucleotides and their Constituents. Recommendations 1970”. The Biochemical Journal 120 (3): 449–54. doi:10.1042/bj1200449. ISSN 0306-3283. PMC 1179624. PMID 5499957. オリジナルの5 February 2007時点におけるアーカイブ。.
- ^ a b Ghosh A, Bansal M (April 2003). “A glossary of DNA structures from A to Z”. Acta Crystallographica Section D 59 (Pt 4): 620–26. doi:10.1107/S0907444903003251. ISSN 0907-4449. PMID 12657780.
- ^ Edwards KJ, Brown DG, Spink N, Skelly JV, Neidle S. “RCSB PDB – 1D65: Molecular structure of the B-DNA dodecamer d(CGCAAATTTGCG)2. An examination of propeller twist and minor-groove water structure at 2.2 A resolution.” (英語). www.rcsb.org. 2023年3月27日閲覧。
- ^ Yakovchuk P, Protozanova E, Frank-Kamenetskii MD (2006). “Base-stacking and base-pairing contributions into thermal stability of the DNA double helix”. Nucleic Acids Research 34 (2): 564–74. doi:10.1093/nar/gkj454. ISSN 0305-1048. PMC 1360284. PMID 16449200.
- ^ Tropp BE (2012). Molecular Biology (4th ed.). Sudbury, Mass.: Jones and Barlett Learning. ISBN 978-0-7637-8663-2
- ^ Carr S (1953年). “Watson-Crick Structure of DNA”. Memorial University of Newfoundland. 2016年7月19日時点のオリジナルよりアーカイブ。2016年7月13日閲覧。
- ^ Verma S, Eckstein F (1998). “Modified oligonucleotides: synthesis and strategy for users”. Annual Review of Biochemistry 67: 99–134. doi:10.1146/annurev.biochem.67.1.99. ISSN 0066-4154. PMID 9759484.
- ^ Johnson TB, Coghill RD (1925). “Pyrimidines. CIII. The discovery of 5-methylcytosine in tuberculinic acid, the nucleic acid of the tubercle bacillus.”. Journal of the American Chemical Society 47: 2838–44. doi:10.1021/ja01688a030. ISSN 0002-7863.
- ^ Weigele P, Raleigh EA (October 2016). “Biosynthesis and Function of Modified Bases in Bacteria and Their Viruses”. Chemical Reviews 116 (20): 12655–12687. doi:10.1021/acs.chemrev.6b00114. ISSN 0009-2665. PMID 27319741.
- ^ Kumar S, Chinnusamy V, Mohapatra T (2018). “Epigenetics of Modified DNA Bases: 5-Methylcytosine and Beyond”. Frontiers in Genetics 9: 640. doi:10.3389/fgene.2018.00640. ISSN 1664-8021. PMC 6305559. PMID 30619465.
- ^ Carell T, Kurz MQ, Müller M, Rossa M, Spada F (April 2018). “Non-canonical Bases in the Genome: The Regulatory Information Layer in DNA”. Angewandte Chemie 57 (16): 4296–4312. doi:10.1002/anie.201708228. PMID 28941008.
- ^ Wing R, Drew H, Takano T, Broka C, Tanaka S, Itakura K, Dickerson RE (October 1980). “Crystal structure analysis of a complete turn of B-DNA”. Nature 287 (5784): 755–58. Bibcode: 1980Natur.287..755W. doi:10.1038/287755a0. PMID 7432492.
- ^ a b Pabo CO, Sauer RT (1984). “Protein-DNA recognition”. Annual Review of Biochemistry 53: 293–321. doi:10.1146/annurev.bi.53.070184.001453. PMID 6236744.
- ^ Nikolova EN, Zhou H, Gottardo FL, Alvey HS, Kimsey IJ, Al-Hashimi HM (2013). “A historical account of Hoogsteen base-pairs in duplex DNA”. Biopolymers 99 (12): 955–68. doi:10.1002/bip.22334. PMC 3844552. PMID 23818176.
- ^ Clausen-Schaumann H, Rief M, Tolksdorf C, Gaub HE (April 2000). “Mechanical stability of single DNA molecules”. Biophysical Journal 78 (4): 1997–2007. Bibcode: 2000BpJ....78.1997C. doi:10.1016/S0006-3495(00)76747-6. PMC 1300792. PMID 10733978.
- ^ Chalikian TV, Völker J, Plum GE, Breslauer KJ (July 1999). “A more unified picture for the thermodynamics of nucleic acid duplex melting: a characterization by calorimetric and volumetric techniques”. Proceedings of the National Academy of Sciences of the United States of America 96 (14): 7853–58. Bibcode: 1999PNAS...96.7853C. doi:10.1073/pnas.96.14.7853. PMC 22151. PMID 10393911.
- ^ deHaseth PL, Helmann JD (June 1995). “Open complex formation by Escherichia coli RNA polymerase: the mechanism of polymerase-induced strand separation of double helical DNA”. Molecular Microbiology 16 (5): 817–24. doi:10.1111/j.1365-2958.1995.tb02309.x. PMID 7476180.
- ^ Isaksson J, Acharya S, Barman J, Cheruku P, Chattopadhyaya J (December 2004). “Single-stranded adenine-rich DNA and RNA retain structural characteristics of their respective double-stranded conformations and show directional differences in stacking pattern”. Biochemistry 43 (51): 15996–6010. doi:10.1021/bi048221v. PMID 15609994. オリジナルの10 June 2007時点におけるアーカイブ。.
- ^ a b Piovesan A, Pelleri MC, Antonaros F, Strippoli P, Caracausi M, Vitale L (2019). “On the length, weight and GC content of the human genome.”. BMC Res Notes 12 (1): 106. doi:10.1186/s13104-019-4137-z. PMC 6391780. PMID 30813969.
- ^ Gregory SG, Barlow KF, McLay KE, Kaul R, Swarbreck D, Dunham A, Scott CE, Howe KL, Woodfine K, Spencer CC, Jones MC, Gillson C, Searle S, Zhou Y, Kokocinski F, McDonald L, Evans R, Phillips K, Atkinson A, Cooper R, Jones C, Hall RE, Andrews TD, Lloyd C, Ainscough R, Almeida JP, Ambrose KD, Anderson F, Andrew RW, Ashwell RI, Aubin K, Babbage AK, Bagguley CL, Bailey J, Beasley H, Bethel G, Bird CP, Bray-Allen S, Brown JY, Brown AJ, Buckley D, Burton J, Bye J, Carder C, Chapman JC, Clark SY, Clarke G, Clee C, Cobley V, Collier RE, Corby N, Coville GJ, Davies J, Deadman R, Dunn M, Earthrowl M, Ellington AG, Errington H, Frankish A, Frankland J, French L, Garner P, Garnett J, Gay L, Ghori MR, Gibson R, Gilby LM, Gillett W, Glithero RJ, Grafham DV, Griffiths C, Griffiths-Jones S, Grocock R, Hammond S, Harrison ES, Hart E, Haugen E, Heath PD, Holmes S, Holt K, Howden PJ, Hunt AR, Hunt SE, Hunter G, Isherwood J, James R, Johnson C, Johnson D, Joy A, Kay M, Kershaw JK, Kibukawa M, Kimberley AM, King A, Knights AJ, Lad H, Laird G, Lawlor S, Leongamornlert DA, Lloyd DM, Loveland J, Lovell J, Lush MJ, Lyne R, Martin S, Mashreghi-Mohammadi M, Matthews L, Matthews NS, McLaren S, Milne S, Mistry S, Moore MJ, Nickerson T, O'Dell CN, Oliver K, Palmeiri A, Palmer SA, Parker A, Patel D, Pearce AV, Peck AI, Pelan S, Phelps K, Phillimore BJ, Plumb R, Rajan J, Raymond C, Rouse G, Saenphimmachak C, Sehra HK, Sheridan E, Shownkeen R, Sims S, Skuce CD, Smith M, Steward C, Subramanian S, Sycamore N, Tracey A, Tromans A, Van Helmond Z, Wall M, Wallis JM, White S, Whitehead SL, Wilkinson JE, Willey DL, Williams H, Wilming L, Wray PW, Wu Z, Coulson A, Vaudin M, Sulston JE, Durbin R, Hubbard T, Wooster R, Dunham I, Carter NP, McVean G, Ross MT, Harrow J, Olson MV, Beck S, Rogers J, Bentley DR, Banerjee R, Bryant SP, Burford DC, Burrill WD, Clegg SM, Dhami P, Dovey O, Faulkner LM, Gribble SM, Langford CF, Pandian RD, Porter KM, Prigmore E (May 2006). “The DNA sequence and biological annotation of human chromosome 1”. Nature 441 (7091): 315–21. Bibcode: 2006Natur.441..315G. doi:10.1038/nature04727. PMID 16710414.
- ^ Anderson S, Bankier AT, Barrell BG, de Bruijn MH, Coulson AR, Drouin J, Eperon IC, Nierlich DP, Roe BA, Sanger F, Schreier PH, Smith AJ, Staden R, Young IG (April 1981). “Sequence and organization of the human mitochondrial genome”. Nature 290 (5806): 457–465. Bibcode: 1981Natur.290..457A. doi:10.1038/290457a0. PMID 7219534.
- ^ “Untitled”. 2011年8月13日時点のオリジナルよりアーカイブ。2012年6月13日閲覧。
- ^ a b c Satoh M, Kuroiwa T (September 1991). “Organization of multiple nucleoids and DNA molecules in mitochondria of a human cell”. Experimental Cell Research 196 (1): 137–140. doi:10.1016/0014-4827(91)90467-9. PMID 1715276.
- ^ Zhang D, Keilty D, Zhang ZF, Chian RC (March 2017). “Mitochondria in oocyte aging: current understanding”. Facts, Views & Vision in ObGyn 9 (1): 29–38. PMC 5506767. PMID 28721182.
- ^ Designation of the two strands of DNA Archived 24 April 2008 at the Wayback Machine. JCBN/NC-IUB Newsletter 1989. Retrieved 7 May 2008
- ^ Hüttenhofer A, Schattner P, Polacek N (May 2005). “Non-coding RNAs: hope or hype?”. Trends in Genetics 21 (5): 289–97. doi:10.1016/j.tig.2005.03.007. PMID 15851066.
- ^ Munroe SH (November 2004). “Diversity of antisense regulation in eukaryotes: multiple mechanisms, emerging patterns”. Journal of Cellular Biochemistry 93 (4): 664–71. doi:10.1002/jcb.20252. PMID 15389973.
- ^ Makalowska I, Lin CF, Makalowski W (February 2005). “Overlapping genes in vertebrate genomes”. Computational Biology and Chemistry 29 (1): 1–12. doi:10.1016/j.compbiolchem.2004.12.006. PMID 15680581.
- ^ Johnson ZI, Chisholm SW (November 2004). “Properties of overlapping genes are conserved across microbial genomes”. Genome Research 14 (11): 2268–72. doi:10.1101/gr.2433104. PMC 525685. PMID 15520290.
- ^ Lamb RA, Horvath CM (August 1991). “Diversity of coding strategies in influenza viruses”. Trends in Genetics 7 (8): 261–66. doi:10.1016/0168-9525(91)90326-L. PMC 7173306. PMID 1771674.
- ^ Benham CJ, Mielke SP (2005). “DNA mechanics”. Annual Review of Biomedical Engineering 7: 21–53. doi:10.1146/annurev.bioeng.6.062403.132016. PMID 16004565. オリジナルの1 March 2019時点におけるアーカイブ。.
- ^ a b Champoux JJ (2001). “DNA topoisomerases: structure, function, and mechanism”. Annual Review of Biochemistry 70: 369–413. doi:10.1146/annurev.biochem.70.1.369. PMID 11395412.
- ^ a b Wang JC (June 2002). “Cellular roles of DNA topoisomerases: a molecular perspective”. Nature Reviews Molecular Cell Biology 3 (6): 430–40. doi:10.1038/nrm831. PMID 12042765.
- ^ Basu HS, Feuerstein BG, Zarling DA, Shafer RH, Marton LJ (October 1988). “Recognition of Z-RNA and Z-DNA determinants by polyamines in solution: experimental and theoretical studies”. Journal of Biomolecular Structure & Dynamics 6 (2): 299–309. doi:10.1080/07391102.1988.10507714. PMID 2482766.
- ^ *Franklin RE, Gosling RG (6 March 1953). “The Structure of Sodium Thymonucleate Fibres I. The Influence of Water Content”. Acta Crystallogr 6 (8–9): 673–77. doi:10.1107/S0365110X53001939. オリジナルの9 January 2016時点におけるアーカイブ。.
- Franklin RE, Gosling RG (1953). “The structure of sodium thymonucleate fibres. II. The cylindrically symmetrical Patterson function”. Acta Crystallogr 6 (8–9): 678–85. doi:10.1107/S0365110X53001940. オリジナルの2017-06-29時点におけるアーカイブ。.
- ^ a b Franklin RE, Gosling RG (April 1953). “Molecular configuration in sodium thymonucleate”. Nature 171 (4356): 740–41. Bibcode: 1953Natur.171..740F. doi:10.1038/171740a0. PMID 13054694. オリジナルの3 January 2011時点におけるアーカイブ。.
- ^ a b Wilkins MH, Stokes AR, Wilson HR (April 1953). “Molecular structure of deoxypentose nucleic acids”. Nature 171 (4356): 738–40. Bibcode: 1953Natur.171..738W. doi:10.1038/171738a0. PMID 13054693. オリジナルの13 May 2011時点におけるアーカイブ。.
- ^ Leslie AG, Arnott S, Chandrasekaran R, Ratliff RL (October 1980). “Polymorphism of DNA double helices”. Journal of Molecular Biology 143 (1): 49–72. doi:10.1016/0022-2836(80)90124-2. PMID 7441761.
- ^ Baianu IC (1980). “Structural Order and Partial Disorder in Biological systems”. Bull. Math. Biol. 42 (4): 137–41. doi:10.1007/BF02462372.
- ^ Hosemann R, Bagchi RN (1962). Direct analysis of diffraction by matter. Amsterdam – New York: North-Holland Publishers
- ^ Baianu IC (1978). “X-ray scattering by partially disordered membrane systems”. Acta Crystallogr A 34 (5): 751–53. Bibcode: 1978AcCrA..34..751B. doi:10.1107/S0567739478001540. オリジナルの14 March 2020時点におけるアーカイブ。 2019年8月29日閲覧。.
- ^ Wahl MC, Sundaralingam M (1997). “Crystal structures of A-DNA duplexes”. Biopolymers 44 (1): 45–63. doi:10.1002/(SICI)1097-0282(1997)44:1<45::AID-BIP4>3.0.CO;2-#. PMID 9097733.
- ^ Lu XJ, Shakked Z, Olson WK (July 2000). “A-form conformational motifs in ligand-bound DNA structures”. Journal of Molecular Biology 300 (4): 819–40. doi:10.1006/jmbi.2000.3690. PMID 10891271.
- ^ Rothenburg S, Koch-Nolte F, Haag F (December 2001). “DNA methylation and Z-DNA formation as mediators of quantitative differences in the expression of alleles”. Immunological Reviews 184: 286–98. doi:10.1034/j.1600-065x.2001.1840125.x. PMID 12086319.
- ^ Oh DB, Kim YG, Rich A (December 2002). “Z-DNA-binding proteins can act as potent effectors of gene expression in vivo”. Proceedings of the National Academy of Sciences of the United States of America 99 (26): 16666–71. Bibcode: 2002PNAS...9916666O. doi:10.1073/pnas.262672699. PMC 139201. PMID 12486233.
- ^ Palmer J (2010年12月2日). “Arsenic-loving bacteria may help in hunt for alien life”. BBC News. オリジナルの2010年12月3日時点におけるアーカイブ。 2010年12月2日閲覧。
- ^ a b Bortman H (2010年12月2日). “Arsenic-Eating Bacteria Opens New Possibilities for Alien Life”. オリジナルの2010年12月4日時点におけるアーカイブ。 2010年12月2日閲覧。
- ^ Katsnelson A (2 December 2010). “Arsenic-eating microbe may redefine chemistry of life”. Nature News. doi:10.1038/news.2010.645. オリジナルの12 February 2012時点におけるアーカイブ。.
- ^ Cressey D (3 October 2012). “'Arsenic-life' Bacterium Prefers Phosphorus after all”. Nature News. doi:10.1038/nature.2012.11520.
- ^ “Structure and packing of human telomeric DNA”. ndbserver.rutgers.edu. 2023年5月18日閲覧。
- ^ a b Greider CW, Blackburn EH (December 1985). “Identification of a specific telomere terminal transferase activity in Tetrahymena extracts”. Cell 43 (2 Pt 1): 405–13. doi:10.1016/0092-8674(85)90170-9. PMID 3907856.
- ^ a b c Nugent CI, Lundblad V (April 1998). “The telomerase reverse transcriptase: components and regulation”. Genes & Development 12 (8): 1073–85. doi:10.1101/gad.12.8.1073. PMID 9553037.
- ^ Wright WE, Tesmer VM, Huffman KE, Levene SD, Shay JW (November 1997). “Normal human chromosomes have long G-rich telomeric overhangs at one end”. Genes & Development 11 (21): 2801–09. doi:10.1101/gad.11.21.2801. PMC 316649. PMID 9353250.
- ^ a b Burge S, Parkinson GN, Hazel P, Todd AK, Neidle S (2006). “Quadruplex DNA: sequence, topology and structure”. Nucleic Acids Research 34 (19): 5402–15. doi:10.1093/nar/gkl655. PMC 1636468. PMID 17012276.
- ^ Parkinson GN, Lee MP, Neidle S (June 2002). “Crystal structure of parallel quadruplexes from human telomeric DNA”. Nature 417 (6891): 876–80. Bibcode: 2002Natur.417..876P. doi:10.1038/nature755. PMID 12050675.
- ^ Griffith JD, Comeau L, Rosenfield S, Stansel RM, Bianchi A, Moss H, de Lange T (May 1999). “Mammalian telomeres end in a large duplex loop”. Cell 97 (4): 503–14. doi:10.1016/S0092-8674(00)80760-6. PMID 10338214.
- ^ Seeman NC (November 2005). “DNA enables nanoscale control of the structure of matter”. Quarterly Reviews of Biophysics 38 (4): 363–71. doi:10.1017/S0033583505004087. PMC 3478329. PMID 16515737.
- ^ Warren M (21 February 2019). “Four new DNA letters double life's alphabet”. Nature 566 (7745): 436. Bibcode: 2019Natur.566..436W. doi:10.1038/d41586-019-00650-8. PMID 30809059.
- ^ Hoshika S, Leal NA, Kim MJ, Kim MS, Karalkar NB, Kim HJ, Bates AM, Watkins NE, SantaLucia HA, Meyer AJ, DasGupta S, Piccirilli JA, Ellington AD, SantaLucia J, Georgiadis MM, Benner SA (22 February 2019). “Hachimoji DNA and RNA: A genetic system with eight building blocks (paywall)”. Science 363 (6429): 884–887. Bibcode: 2019Sci...363..884H. doi:10.1126/science.aat0971. PMC 6413494. PMID 30792304.
- ^ Burghardt B, Hartmann AK (February 2007). “RNA secondary structure design”. Physical Review E 75 (2): 021920. arXiv:physics/0609135. Bibcode: 2007PhRvE..75b1920B. doi:10.1103/PhysRevE.75.021920. PMID 17358380.
- ^ Reusch W. “Nucleic Acids”. Michigan State University. 2022年6月30日閲覧。
- ^ “How To Extract DNA From Anything Living”. University of Utah. 2022年6月30日閲覧。
- ^ Hu Q, Rosenfeld MG (2012). “Epigenetic regulation of human embryonic stem cells”. Frontiers in Genetics 3: 238. doi:10.3389/fgene.2012.00238. PMC 3488762. PMID 23133442.
- ^ Klose RJ, Bird AP (February 2006). “Genomic DNA methylation: the mark and its mediators”. Trends in Biochemical Sciences 31 (2): 89–97. doi:10.1016/j.tibs.2005.12.008. PMID 16403636.
- ^ Bird A (January 2002). “DNA methylation patterns and epigenetic memory”. Genes & Development 16 (1): 6–21. doi:10.1101/gad.947102. PMID 11782440.
- ^ Walsh CP, Xu GL (2006). “Cytosine methylation and DNA repair”. Current Topics in Microbiology and Immunology 301: 283–315. doi:10.1007/3-540-31390-7_11. ISBN 3-540-29114-8. PMID 16570853.
- ^ Kriaucionis S, Heintz N (May 2009). “The nuclear DNA base 5-hydroxymethylcytosine is present in Purkinje neurons and the brain”. Science 324 (5929): 929–30. Bibcode: 2009Sci...324..929K. doi:10.1126/science.1169786. PMC 3263819. PMID 19372393.
- ^ Ratel D, Ravanat JL, Berger F, Wion D (March 2006). “N6-methyladenine: the other methylated base of DNA”. BioEssays 28 (3): 309–15. doi:10.1002/bies.20342. PMC 2754416. PMID 16479578.
- ^ Gommers-Ampt JH, Van Leeuwen F, de Beer AL, Vliegenthart JF, Dizdaroglu M, Kowalak JA, Crain PF, Borst P (December 1993). “beta-D-glucosyl-hydroxymethyluracil: a novel modified base present in the DNA of the parasitic protozoan T. brucei”. Cell 75 (6): 1129–36. doi:10.1016/0092-8674(93)90322-H. hdl:1874/5219. PMID 8261512.
- ^ Created from PDB 1JDG Archived 22 September 2008 at the Wayback Machine.
- ^ Douki T, Reynaud-Angelin A, Cadet J, Sage E (August 2003). “Bipyrimidine photoproducts rather than oxidative lesions are the main type of DNA damage involved in the genotoxic effect of solar UVA radiation”. Biochemistry 42 (30): 9221–26. doi:10.1021/bi034593c. PMID 12885257.
- ^ Cadet J, Delatour T, Douki T, Gasparutto D, Pouget JP, Ravanat JL, Sauvaigo S (March 1999). “Hydroxyl radicals and DNA base damage”. Mutation Research 424 (1–2): 9–21. doi:10.1016/S0027-5107(99)00004-4. PMID 10064846.
- ^ Beckman KB, Ames BN (August 1997). “Oxidative decay of DNA”. The Journal of Biological Chemistry 272 (32): 19633–36. doi:10.1074/jbc.272.32.19633. PMID 9289489.
- ^ Valerie K, Povirk LF (September 2003). “Regulation and mechanisms of mammalian double-strand break repair”. Oncogene 22 (37): 5792–812. doi:10.1038/sj.onc.1206679. PMID 12947387.
- ^ Johnson G (2010年12月28日). “Unearthing Prehistoric Tumors, and Debate”. The New York Times. オリジナルの2017年6月24日時点におけるアーカイブ。. "If we lived long enough, sooner or later we all would get cancer."
- ^ Alberts B, Johnson A, Lewis J (2002). “The Preventable Causes of Cancer”. Molecular biology of the cell (4th ed.). New York: Garland Science. ISBN 0-8153-4072-9. オリジナルの2 January 2016時点におけるアーカイブ。. "A certain irreducible background incidence of cancer is to be expected regardless of circumstances: mutations can never be absolutely avoided, because they are an inescapable consequence of fundamental limitations on the accuracy of DNA replication, as discussed in Chapter 5. If a human could live long enough, it is inevitable that at least one of his or her cells would eventually accumulate a set of mutations sufficient for cancer to develop."
- ^ Bernstein H, Payne CM, Bernstein C, Garewal H, Dvorak K (2008). “Cancer and aging as consequences of un-repaired DNA damage”. New Research on DNA Damage. New York: Nova Science Publishers. pp. 1–47. ISBN 978-1-60456-581-2. オリジナルの25 October 2014時点におけるアーカイブ。
- ^ Hoeijmakers JH (October 2009). “DNA damage, aging, and cancer”. The New England Journal of Medicine 361 (15): 1475–85. doi:10.1056/NEJMra0804615. PMID 19812404.
- ^ Freitas AA, de Magalhães JP (2011). “A review and appraisal of the DNA damage theory of ageing”. Mutation Research 728 (1–2): 12–22. doi:10.1016/j.mrrev.2011.05.001. PMID 21600302.
- ^ Ferguson LR, Denny WA (September 1991). “The genetic toxicology of acridines”. Mutation Research 258 (2): 123–60. doi:10.1016/0165-1110(91)90006-H. PMID 1881402.
- ^ Stephens TD, Bunde CJ, Fillmore BJ (June 2000). “Mechanism of action in thalidomide teratogenesis”. Biochemical Pharmacology 59 (12): 1489–99. doi:10.1016/S0006-2952(99)00388-3. PMID 10799645.
- ^ Jeffrey AM (1985). “DNA modification by chemical carcinogens”. Pharmacology & Therapeutics 28 (2): 237–72. doi:10.1016/0163-7258(85)90013-0. PMID 3936066.
- ^ Braña MF, Cacho M, Gradillas A, de Pascual-Teresa B, Ramos A (November 2001). “Intercalators as anticancer drugs”. Current Pharmaceutical Design 7 (17): 1745–80. doi:10.2174/1381612013397113. PMID 11562309.
- ^ Venter JC, Adams MD, Myers EW, Li PW, Mural RJ, Sutton GG, Smith HO, Yandell M, Evans CA, Holt RA, Gocayne JD, Amanatides P, Ballew RM, Huson DH, Wortman JR, Zhang Q, Kodira CD, Zheng XH, Chen L, Skupski M, Subramanian G, Thomas PD, Zhang J, Gabor Miklos GL, Nelson C, Broder S, Clark AG, Nadeau J, McKusick VA, Zinder N, Levine AJ, Roberts RJ, Simon M, Slayman C, Hunkapiller M, Bolanos R, Delcher A, Dew I, Fasulo D, Flanigan M, Florea L, Halpern A, Hannenhalli S, Kravitz S, Levy S, Mobarry C, Reinert K, Remington K, Abu-Threideh J, Beasley E, Biddick K, Bonazzi V, Brandon R, Cargill M, Chandramouliswaran I, Charlab R, Chaturvedi K, Deng Z, Di Francesco V, Dunn P, Eilbeck K, Evangelista C, Gabrielian AE, Gan W, Ge W, Gong F, Gu Z, Guan P, Heiman TJ, Higgins ME, Ji RR, Ke Z, Ketchum KA, Lai Z, Lei Y, Li Z, Li J, Liang Y, Lin X, Lu F, Merkulov GV, Milshina N, Moore HM, Naik AK, Narayan VA, Neelam B, Nusskern D, Rusch DB, Salzberg S, Shao W, Shue B, Sun J, Wang Z, Wang A, Wang X, Wang J, Wei M, Wides R, Xiao C, Yan C, Yao A, Ye J, Zhan M, Zhang W, Zhang H, Zhao Q, Zheng L, Zhong F, Zhong W, Zhu S, Zhao S, Gilbert D, Baumhueter S, Spier G, Carter C, Cravchik A, Woodage T, Ali F, An H, Awe A, Baldwin D, Baden H, Barnstead M, Barrow I, Beeson K, Busam D, Carver A, Center A, Cheng ML, Curry L, Danaher S, Davenport L, Desilets R, Dietz S, Dodson K, Doup L, Ferriera S, Garg N, Gluecksmann A, Hart B, Haynes J, Haynes C, Heiner C, Hladun S, Hostin D, Houck J, Howland T, Ibegwam C, Johnson J, Kalush F, Kline L, Koduru S, Love A, Mann F, May D, McCawley S, McIntosh T, McMullen I, Moy M, Moy L, Murphy B, Nelson K, Pfannkoch C, Pratts E, Puri V, Qureshi H, Reardon M, Rodriguez R, Rogers YH, Romblad D, Ruhfel B, Scott R, Sitter C, Smallwood M, Stewart E, Strong R, Suh E, Thomas R, Tint NN, Tse S, Vech C, Wang G, Wetter J, Williams S, Williams M, Windsor S, Winn-Deen E, Wolfe K, Zaveri J, Zaveri K, Abril JF, Guigó R, Campbell MJ, Sjolander KV, Karlak B, Kejariwal A, Mi H, Lazareva B, Hatton T, Narechania A, Diemer K, Muruganujan A, Guo N, Sato S, Bafna V, Istrail S, Lippert R, Schwartz R, Walenz B, Yooseph S, Allen D, Basu A, Baxendale J, Blick L, Caminha M, Carnes-Stine J, Caulk P, Chiang YH, Coyne M, Dahlke C, Mays A, Dombroski M, Donnelly M, Ely D, Esparham S, Fosler C, Gire H, Glanowski S, Glasser K, Glodek A, Gorokhov M, Graham K, Gropman B, Harris M, Heil J, Henderson S, Hoover J, Jennings D, Jordan C, Jordan J, Kasha J, Kagan L, Kraft C, Levitsky A, Lewis M, Liu X, Lopez J, Ma D, Majoros W, McDaniel J, Murphy S, Newman M, Nguyen T, Nguyen N, Nodell M, Pan S, Peck J, Peterson M, Rowe W, Sanders R, Scott J, Simpson M, Smith T, Sprague A, Stockwell T, Turner R, Venter E, Wang M, Wen M, Wu D, Wu M, Xia A, Zandieh A, Zhu X (February 2001). “The sequence of the human genome”. Science 291 (5507): 1304–51. Bibcode: 2001Sci...291.1304V. doi:10.1126/science.1058040. PMID 11181995.
- ^ Thanbichler M, Wang SC, Shapiro L (October 2005). “The bacterial nucleoid: a highly organized and dynamic structure”. Journal of Cellular Biochemistry 96 (3): 506–21. doi:10.1002/jcb.20519. PMID 15988757.
- ^ Wolfsberg TG, McEntyre J, Schuler GD (February 2001). “Guide to the draft human genome”. Nature 409 (6822): 824–26. Bibcode: 2001Natur.409..824W. doi:10.1038/35057000. PMID 11236998.
- ^ Gregory TR (January 2005). “The C-value enigma in plants and animals: a review of parallels and an appeal for partnership”. Annals of Botany 95 (1): 133–46. doi:10.1093/aob/mci009. PMC 4246714. PMID 15596463.
- ^ Birney E, Stamatoyannopoulos JA, Dutta A, Guigó R, Gingeras TR, Margulies EH, Weng Z, Snyder M, Dermitzakis ET, Thurman RE, Kuehn MS, Taylor CM, Neph S, Koch CM, Asthana S, Malhotra A, Adzhubei I, Greenbaum JA, Andrews RM, Flicek P, Boyle PJ, Cao H, Carter NP, Clelland GK, Davis S, Day N, Dhami P, Dillon SC, Dorschner MO, Fiegler H, Giresi PG, Goldy J, Hawrylycz M, Haydock A, Humbert R, James KD, Johnson BE, Johnson EM, Frum TT, Rosenzweig ER, Karnani N, Lee K, Lefebvre GC, Navas PA, Neri F, Parker SC, Sabo PJ, Sandstrom R, Shafer A, Vetrie D, Weaver M, Wilcox S, Yu M, Collins FS, Dekker J, Lieb JD, Tullius TD, Crawford GE, Sunyaev S, Noble WS, Dunham I, Denoeud F, Reymond A, Kapranov P, Rozowsky J, Zheng D, Castelo R, Frankish A, Harrow J, Ghosh S, Sandelin A, Hofacker IL, Baertsch R, Keefe D, Dike S, Cheng J, Hirsch HA, Sekinger EA, Lagarde J, Abril JF, Shahab A, Flamm C, Fried C, Hackermüller J, Hertel J, Lindemeyer M, Missal K, Tanzer A, Washietl S, Korbel J, Emanuelsson O, Pedersen JS, Holroyd N, Taylor R, Swarbreck D, Matthews N, Dickson MC, Thomas DJ, Weirauch MT, Gilbert J, Drenkow J, Bell I, Zhao X, Srinivasan KG, Sung WK, Ooi HS, Chiu KP, Foissac S, Alioto T, Brent M, Pachter L, Tress ML, Valencia A, Choo SW, Choo CY, Ucla C, Manzano C, Wyss C, Cheung E, Clark TG, Brown JB, Ganesh M, Patel S, Tammana H, Chrast J, Henrichsen CN, Kai C, Kawai J, Nagalakshmi U, Wu J, Lian Z, Lian J, Newburger P, Zhang X, Bickel P, Mattick JS, Carninci P, Hayashizaki Y, Weissman S, Hubbard T, Myers RM, Rogers J, Stadler PF, Lowe TM, Wei CL, Ruan Y, Struhl K, Gerstein M, Antonarakis SE, Fu Y, Green ED, Karaöz U, Siepel A, Taylor J, Liefer LA, Wetterstrand KA, Good PJ, Feingold EA, Guyer MS, Cooper GM, Asimenos G, Dewey CN, Hou M, Nikolaev S, Montoya-Burgos JI, Löytynoja A, Whelan S, Pardi F, Massingham T, Huang H, Zhang NR, Holmes I, Mullikin JC, Ureta-Vidal A, Paten B, Seringhaus M, Church D, Rosenbloom K, Kent WJ, Stone EA, Batzoglou S, Goldman N, Hardison RC, Haussler D, Miller W, Sidow A, Trinklein ND, Zhang ZD, Barrera L, Stuart R, King DC, Ameur A, Enroth S, Bieda MC, Kim J, Bhinge AA, Jiang N, Liu J, Yao F, Vega VB, Lee CW, Ng P, Shahab A, Yang A, Moqtaderi Z, Zhu Z, Xu X, Squazzo S, Oberley MJ, Inman D, Singer MA, Richmond TA, Munn KJ, Rada-Iglesias A, Wallerman O, Komorowski J, Fowler JC, Couttet P, Bruce AW, Dovey OM, Ellis PD, Langford CF, Nix DA, Euskirchen G, Hartman S, Urban AE, Kraus P, Van Calcar S, Heintzman N, Kim TH, Wang K, Qu C, Hon G, Luna R, Glass CK, Rosenfeld MG, Aldred SF, Cooper SJ, Halees A, Lin JM, Shulha HP, Zhang X, Xu M, Haidar JN, Yu Y, Ruan Y, Iyer VR, Green RD, Wadelius C, Farnham PJ, Ren B, Harte RA, Hinrichs AS, Trumbower H, Clawson H, Hillman-Jackson J, Zweig AS, Smith K, Thakkapallayil A, Barber G, Kuhn RM, Karolchik D, Armengol L, Bird CP, de Bakker PI, Kern AD, Lopez-Bigas N, Martin JD, Stranger BE, Woodroffe A, Davydov E, Dimas A, Eyras E, Hallgrímsdóttir IB, Huppert J, Zody MC, Abecasis GR, Estivill X, Bouffard GG, Guan X, Hansen NF, Idol JR, Maduro VV, Maskeri B, McDowell JC, Park M, Thomas PJ, Young AC, Blakesley RW, Muzny DM, Sodergren E, Wheeler DA, Worley KC, Jiang H, Weinstock GM, Gibbs RA, Graves T, Fulton R, Mardis ER, Wilson RK, Clamp M, Cuff J, Gnerre S, Jaffe DB, Chang JL, Lindblad-Toh K, Lander ES, Koriabine M, Nefedov M, Osoegawa K, Yoshinaga Y, Zhu B, de Jong PJ (June 2007). “Identification and analysis of functional elements in 1% of the human genome by the ENCODE pilot project”. Nature 447 (7146): 799–816. Bibcode: 2007Natur.447..799B. doi:10.1038/nature05874. PMC 2212820. PMID 17571346.
- ^ Yin YW, Steitz TA. “RCSB PDB – 1MSW: Structural basis for the transition from initiation to elongation transcription in T7 RNA polymerase” (英語). www.rcsb.org. 2023年3月27日閲覧。
- ^ Pidoux AL, Allshire RC (March 2005). “The role of heterochromatin in centromere function”. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences 360 (1455): 569–79. doi:10.1098/rstb.2004.1611. PMC 1569473. PMID 15905142.
- ^ Harrison PM, Hegyi H, Balasubramanian S, Luscombe NM, Bertone P, Echols N, Johnson T, Gerstein M (February 2002). “Molecular fossils in the human genome: identification and analysis of the pseudogenes in chromosomes 21 and 22”. Genome Research 12 (2): 272–80. doi:10.1101/gr.207102. PMC 155275. PMID 11827946.
- ^ Harrison PM, Gerstein M (May 2002). “Studying genomes through the aeons: protein families, pseudogenes and proteome evolution”. Journal of Molecular Biology 318 (5): 1155–74. doi:10.1016/S0022-2836(02)00109-2. PMID 12083509.
- ^ Albà M (2001). “Replicative DNA polymerases”. Genome Biology 2 (1): REVIEWS3002. doi:10.1186/gb-2001-2-1-reviews3002. PMC 150442. PMID 11178285.
- ^ Tani K, Nasu M (2010). “Roles of Extracellular DNA in Bacterial Ecosystems”. Extracellular Nucleic Acids. Springer. pp. 25–38. ISBN 978-3-642-12616-1
- ^ Vlassov VV, Laktionov PP, Rykova EY (July 2007). “Extracellular nucleic acids”. BioEssays 29 (7): 654–67. doi:10.1002/bies.20604. PMID 17563084.
- ^ Finkel SE, Kolter R (November 2001). “DNA as a nutrient: novel role for bacterial competence gene homologs”. Journal of Bacteriology 183 (21): 6288–93. doi:10.1128/JB.183.21.6288-6293.2001. PMC 100116. PMID 11591672.
- ^ Mulcahy H, Charron-Mazenod L, Lewenza S (November 2008). “Extracellular DNA chelates cations and induces antibiotic resistance in Pseudomonas aeruginosa biofilms”. PLOS Pathogens 4 (11): e1000213. doi:10.1371/journal.ppat.1000213. PMC 2581603. PMID 19023416.
- ^ Berne C, Kysela DT, Brun YV (August 2010). “A bacterial extracellular DNA inhibits settling of motile progeny cells within a biofilm”. Molecular Microbiology 77 (4): 815–29. doi:10.1111/j.1365-2958.2010.07267.x. PMC 2962764. PMID 20598083.
- ^ Whitchurch CB, Tolker-Nielsen T, Ragas PC, Mattick JS (February 2002). “Extracellular DNA required for bacterial biofilm formation”. Science 295 (5559): 1487. doi:10.1126/science.295.5559.1487. PMID 11859186.
- ^ Hu W, Li L, Sharma S, Wang J, McHardy I, Lux R, Yang Z, He X, Gimzewski JK, Li Y, Shi W (2012). “DNA builds and strengthens the extracellular matrix in Myxococcus xanthus biofilms by interacting with exopolysaccharides”. PLOS ONE 7 (12): e51905. Bibcode: 2012PLoSO...751905H. doi:10.1371/journal.pone.0051905. PMC 3530553. PMID 23300576.
- ^ Hui L, Bianchi DW (February 2013). “Recent advances in the prenatal interrogation of the human fetal genome”. Trends in Genetics 29 (2): 84–91. doi:10.1016/j.tig.2012.10.013. PMC 4378900. PMID 23158400.
- ^ Foote AD, Thomsen PF, Sveegaard S, Wahlberg M, Kielgast J, Kyhn LA, Salling AB, Galatius A, Orlando L, Gilbert MT (2012). “Investigating the potential use of environmental DNA (eDNA) for genetic monitoring of marine mammals”. PLOS ONE 7 (8): e41781. Bibcode: 2012PLoSO...741781F. doi:10.1371/journal.pone.0041781. PMC 3430683. PMID 22952587.
- ^ “Researchers Detect Land Animals Using DNA in Nearby Water Bodies”. 2020年5月24日閲覧。
- ^ Sandman K, Pereira SL, Reeve JN (December 1998). “Diversity of prokaryotic chromosomal proteins and the origin of the nucleosome”. Cellular and Molecular Life Sciences 54 (12): 1350–64. doi:10.1007/s000180050259. PMID 9893710.
- ^ Dame RT (May 2005). “The role of nucleoid-associated proteins in the organization and compaction of bacterial chromatin”. Molecular Microbiology 56 (4): 858–70. doi:10.1111/j.1365-2958.2005.04598.x. PMID 15853876.
- ^ Luger K, Mäder AW, Richmond RK, Sargent DF, Richmond TJ (September 1997). “Crystal structure of the nucleosome core particle at 2.8 A resolution”. Nature 389 (6648): 251–60. Bibcode: 1997Natur.389..251L. doi:10.1038/38444. PMID 9305837.
- ^ Jenuwein T, Allis CD (August 2001). “Translating the histone code”. Science 293 (5532): 1074–80. doi:10.1126/science.1063127. PMID 11498575. オリジナルの8 August 2017時点におけるアーカイブ。.
- ^ Ito T (2003). “Nucleosome Assembly and Remodeling”. Protein Complexes that Modify Chromatin. Current Topics in Microbiology and Immunology. 274. pp. 1–22. doi:10.1007/978-3-642-55747-7_1. ISBN 978-3-540-44208-0. PMID 12596902
- ^ Thomas JO (August 2001). “HMG1 and 2: architectural DNA-binding proteins”. Biochemical Society Transactions 29 (Pt 4): 395–401. doi:10.1042/BST0290395. PMID 11497996.
- ^ Grosschedl R, Giese K, Pagel J (March 1994). “HMG domain proteins: architectural elements in the assembly of nucleoprotein structures”. Trends in Genetics 10 (3): 94–100. doi:10.1016/0168-9525(94)90232-1. PMID 8178371.
- ^ Iftode C, Daniely Y, Borowiec JA (1999). “Replication protein A (RPA): the eukaryotic SSB”. Critical Reviews in Biochemistry and Molecular Biology 34 (3): 141–80. doi:10.1080/10409239991209255. PMID 10473346.
- ^ Beamer LJ, Pabo CO. “RCSB PDB – 1LMB: Refined 1.8 Å crystal structure of the lambda repressor-operator complex” (英語). www.rcsb.org. 2023年3月27日閲覧。
- ^ Myers LC, Kornberg RD (2000). “Mediator of transcriptional regulation”. Annual Review of Biochemistry 69: 729–49. doi:10.1146/annurev.biochem.69.1.729. PMID 10966474.
- ^ Spiegelman BM, Heinrich R (October 2004). “Biological control through regulated transcriptional coactivators”. Cell 119 (2): 157–67. doi:10.1016/j.cell.2004.09.037. PMID 15479634.
- ^ Li Z, Van Calcar S, Qu C, Cavenee WK, Zhang MQ, Ren B (July 2003). “A global transcriptional regulatory role for c-Myc in Burkitt's lymphoma cells”. Proceedings of the National Academy of Sciences of the United States of America 100 (14): 8164–69. Bibcode: 2003PNAS..100.8164L. doi:10.1073/pnas.1332764100. PMC 166200. PMID 12808131.
- ^ Kostrewa D, Winkler FK. “RCSB PDB – 1RVA: Mg2+ binding to the active site of EcoRV endonuclease: a crystallographic study of complexes with substrate and product DNA at 2 Å resolution” (英語). www.rcsb.org. 2023年3月27日閲覧。
- ^ Bickle TA, Krüger DH (June 1993). “Biology of DNA restriction”. Microbiological Reviews 57 (2): 434–50. doi:10.1128/MMBR.57.2.434-450.1993. PMC 372918. PMID 8336674.
- ^ a b Doherty AJ, Suh SW (November 2000). “Structural and mechanistic conservation in DNA ligases”. Nucleic Acids Research 28 (21): 4051–58. doi:10.1093/nar/28.21.4051. PMC 113121. PMID 11058099.
- ^ Schoeffler AJ, Berger JM (December 2005). “Recent advances in understanding structure-function relationships in the type II topoisomerase mechanism”. Biochemical Society Transactions 33 (Pt 6): 1465–70. doi:10.1042/BST20051465. PMID 16246147.
- ^ Tuteja N, Tuteja R (May 2004). “Unraveling DNA helicases. Motif, structure, mechanism and function”. European Journal of Biochemistry 271 (10): 1849–63. doi:10.1111/j.1432-1033.2004.04094.x. PMID 15128295.
- ^ Joyce CM, Steitz TA (November 1995). “Polymerase structures and function: variations on a theme?”. Journal of Bacteriology 177 (22): 6321–29. doi:10.1128/jb.177.22.6321-6329.1995. PMC 177480. PMID 7592405.
- ^ Hubscher U, Maga G, Spadari S (2002). “Eukaryotic DNA polymerases”. Annual Review of Biochemistry 71: 133–63. doi:10.1146/annurev.biochem.71.090501.150041. PMID 12045093. オリジナルの26 January 2021時点におけるアーカイブ。.
- ^ Johnson A, O'Donnell M (2005). “Cellular DNA replicases: components and dynamics at the replication fork”. Annual Review of Biochemistry 74: 283–315. doi:10.1146/annurev.biochem.73.011303.073859. PMID 15952889.
- ^ a b Tarrago-Litvak L, Andréola ML, Nevinsky GA, Sarih-Cottin L, Litvak S (May 1994). “The reverse transcriptase of HIV-1: from enzymology to therapeutic intervention”. FASEB Journal 8 (8): 497–503. doi:10.1096/fasebj.8.8.7514143. PMID 7514143.
- ^ Martinez E (December 2002). “Multi-protein complexes in eukaryotic gene transcription”. Plant Molecular Biology 50 (6): 925–47. doi:10.1023/A:1021258713850. PMID 12516863.
- ^ Thorpe JH, Gale BC, Teixeira SC, Cardin CJ. “RCSB PDB – 1M6G: Structural Characterisation of the Holliday Junction TCGGTACCGA” (英語). www.rcsb.org. 2023年3月27日閲覧。
- ^ Cremer T, Cremer C (April 2001). “Chromosome territories, nuclear architecture and gene regulation in mammalian cells”. Nature Reviews Genetics 2 (4): 292–301. doi:10.1038/35066075. PMID 11283701.
- ^ Pál C, Papp B, Lercher MJ (May 2006). “An integrated view of protein evolution”. Nature Reviews Genetics 7 (5): 337–48. doi:10.1038/nrg1838. PMID 16619049.
- ^ O'Driscoll M, Jeggo PA (January 2006). “The role of double-strand break repair – insights from human genetics”. Nature Reviews Genetics 7 (1): 45–54. doi:10.1038/nrg1746. PMID 16369571.
- ^ Vispé S, Defais M (October 1997). “Mammalian Rad51 protein: a RecA homologue with pleiotropic functions”. Biochimie 79 (9–10): 587–92. doi:10.1016/S0300-9084(97)82007-X. PMID 9466696.
- ^ Neale MJ, Keeney S (July 2006). “Clarifying the mechanics of DNA strand exchange in meiotic recombination”. Nature 442 (7099): 153–58. Bibcode: 2006Natur.442..153N. doi:10.1038/nature04885. PMC 5607947. PMID 16838012.
- ^ Dickman MJ, Ingleston SM, Sedelnikova SE, Rafferty JB, Lloyd RG, Grasby JA, Hornby DP (November 2002). “The RuvABC resolvasome”. European Journal of Biochemistry 269 (22): 5492–501. doi:10.1046/j.1432-1033.2002.03250.x. PMID 12423347.
- ^ Joyce GF (July 2002). “The antiquity of RNA-based evolution”. Nature 418 (6894): 214–21. Bibcode: 2002Natur.418..214J. doi:10.1038/418214a. PMID 12110897.
- ^ Orgel LE (2004). “Prebiotic chemistry and the origin of the RNA world”. Critical Reviews in Biochemistry and Molecular Biology 39 (2): 99–123. doi:10.1080/10409230490460765. PMID 15217990.
- ^ Davenport RJ (May 2001). “Ribozymes. Making copies in the RNA world”. Science 292 (5520): 1278a–1278. doi:10.1126/science.292.5520.1278a. PMID 11360970.
- ^ Szathmáry E (April 1992). “What is the optimum size for the genetic alphabet?”. Proceedings of the National Academy of Sciences of the United States of America 89 (7): 2614–18. Bibcode: 1992PNAS...89.2614S. doi:10.1073/pnas.89.7.2614. PMC 48712. PMID 1372984.
- ^ Lindahl T (April 1993). “Instability and decay of the primary structure of DNA”. Nature 362 (6422): 709–15. Bibcode: 1993Natur.362..709L. doi:10.1038/362709a0. PMID 8469282.
- ^ Vreeland RH, Rosenzweig WD, Powers DW (October 2000). “Isolation of a 250 million-year-old halotolerant bacterium from a primary salt crystal”. Nature 407 (6806): 897–900. Bibcode: 2000Natur.407..897V. doi:10.1038/35038060. PMID 11057666.
- ^ Hebsgaard MB, Phillips MJ, Willerslev E (May 2005). “Geologically ancient DNA: fact or artefact?”. Trends in Microbiology 13 (5): 212–20. doi:10.1016/j.tim.2005.03.010. PMID 15866038.
- ^ Nickle DC, Learn GH, Rain MW, Mullins JI, Mittler JE (January 2002). “Curiously modern DNA for a "250 million-year-old" bacterium”. Journal of Molecular Evolution 54 (1): 134–37. Bibcode: 2002JMolE..54..134N. doi:10.1007/s00239-001-0025-x. PMID 11734907.
- ^ Callahan MP, Smith KE, Cleaves HJ, Ruzicka J, Stern JC, Glavin DP, House CH, Dworkin JP (August 2011). “Carbonaceous meteorites contain a wide range of extraterrestrial nucleobases”. Proceedings of the National Academy of Sciences of the United States of America 108 (34): 13995–98. Bibcode: 2011PNAS..10813995C. doi:10.1073/pnas.1106493108. PMC 3161613. PMID 21836052.
- ^ Steigerwald J (2011年8月8日). “NASA Researchers: DNA Building Blocks Can Be Made in Space”. NASA. 2015年6月23日時点のオリジナルよりアーカイブ。2011年8月10日閲覧。
- ^ ScienceDaily Staff (2011年8月9日). “DNA Building Blocks Can Be Made in Space, NASA Evidence Suggests”. ScienceDaily. 2011年9月5日時点のオリジナルよりアーカイブ。2011年8月9日閲覧。
- ^ Marlaire R (2015年3月3日). “NASA Ames Reproduces the Building Blocks of Life in Laboratory”. NASA. 2015年3月5日時点のオリジナルよりアーカイブ。2015年3月5日閲覧。
- ^ Hunt K (2021年2月17日). “World's oldest DNA sequenced from a mammoth that lived more than a million years ago”. CNN News 2021年2月17日閲覧。
- ^ Callaway E (17 February 2021). “Million-year-old mammoth genomes shatter record for oldest ancient DNA – Permafrost-preserved teeth, up to 1.6 million years old, identify a new kind of mammoth in Siberia.”. Nature 590 (7847): 537–538. Bibcode: 2021Natur.590..537C. doi:10.1038/d41586-021-00436-x. ISSN 0028-0836. PMID 33597786.
- ^ Goff SP, Berg P (December 1976). “Construction of hybrid viruses containing SV40 and lambda phage DNA segments and their propagation in cultured monkey cells”. Cell 9 (4 PT 2): 695–705. doi:10.1016/0092-8674(76)90133-1. PMID 189942.
- ^ Houdebine LM (2007). “Transgenic animal models in biomedical research”. Target Discovery and Validation Reviews and Protocols. Methods in Molecular Biology. 360. pp. 163–202. doi:10.1385/1-59745-165-7:163. ISBN 978-1-59745-165-9. PMID 17172731
- ^ Daniell H, Dhingra A (April 2002). “Multigene engineering: dawn of an exciting new era in biotechnology”. Current Opinion in Biotechnology 13 (2): 136–41. doi:10.1016/S0958-1669(02)00297-5. PMC 3481857. PMID 11950565.
- ^ Job D (November 2002). “Plant biotechnology in agriculture”. Biochimie 84 (11): 1105–10. doi:10.1016/S0300-9084(02)00013-5. PMID 12595138.
- ^ Curtis C, Hereward J (2017年8月29日). “From the crime scene to the courtroom: the journey of a DNA sample”. The Conversation. オリジナルの2017年10月22日時点におけるアーカイブ。 2017年10月22日閲覧。
- ^ Collins A, Morton NE (June 1994). “Likelihood ratios for DNA identification”. Proceedings of the National Academy of Sciences of the United States of America 91 (13): 6007–11. Bibcode: 1994PNAS...91.6007C. doi:10.1073/pnas.91.13.6007. PMC 44126. PMID 8016106.
- ^ Weir BS, Triggs CM, Starling L, Stowell LI, Walsh KA, Buckleton J (March 1997). “Interpreting DNA mixtures”. Journal of Forensic Sciences 42 (2): 213–22. doi:10.1520/JFS14100J. PMID 9068179.
- ^ Jeffreys AJ, Wilson V, Thein SL (1985). “Individual-specific 'fingerprints' of human DNA”. Nature 316 (6023): 76–79. Bibcode: 1985Natur.316...76J. doi:10.1038/316076a0. PMID 2989708.
- ^ “Colin Pitchfork” (2006年12月14日). 2006年12月14日時点のオリジナルよりアーカイブ。2023年3月27日閲覧。
- ^ “DNA Identification in Mass Fatality Incidents”. National Institute of Justice (2006年9月). 2006年11月12日時点のオリジナルよりアーカイブ。2007年1月1日閲覧。
- ^ Pollack A (2012年6月19日). “Before Birth, Dad's ID” (英語). The New York Times. ISSN 0362-4331. オリジナルの2017年6月24日時点におけるアーカイブ。 2023年3月27日閲覧。
- ^ a b Breaker RR, Joyce GF (December 1994). “A DNA enzyme that cleaves RNA”. Chemistry & Biology 1 (4): 223–29. doi:10.1016/1074-5521(94)90014-0. PMID 9383394.
- ^ Chandra M, Sachdeva A, Silverman SK (October 2009). “DNA-catalyzed sequence-specific hydrolysis of DNA”. Nature Chemical Biology 5 (10): 718–20. doi:10.1038/nchembio.201. PMC 2746877. PMID 19684594.
- ^ Carmi N, Shultz LA, Breaker RR (December 1996). “In vitro selection of self-cleaving DNAs”. Chemistry & Biology 3 (12): 1039–46. doi:10.1016/S1074-5521(96)90170-2. PMID 9000012.
- ^ Torabi SF, Wu P, McGhee CE, Chen L, Hwang K, Zheng N, Cheng J, Lu Y (May 2015). “In vitro selection of a sodium-specific DNAzyme and its application in intracellular sensing”. Proceedings of the National Academy of Sciences of the United States of America 112 (19): 5903–08. Bibcode: 2015PNAS..112.5903T. doi:10.1073/pnas.1420361112. PMC 4434688. PMID 25918425.
- ^ Baldi P, Brunak S (2001). Bioinformatics: The Machine Learning Approach. MIT Press. ISBN 978-0-262-02506-5. OCLC 45951728
- ^ Gusfield D (15 January 1997). Algorithms on Strings, Trees, and Sequences: Computer Science and Computational Biology. Cambridge University Press. ISBN 978-0-521-58519-4
- ^ Sjölander K (January 2004). “Phylogenomic inference of protein molecular function: advances and challenges”. Bioinformatics 20 (2): 170–79. doi:10.1093/bioinformatics/bth021. PMID 14734307.
- ^ Mount DM (2004). Bioinformatics: Sequence and Genome Analysis (2nd ed.). Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press. ISBN 0-87969-712-1. OCLC 55106399
- ^ Strong M (March 2004). “Protein nanomachines”. PLOS Biology 2 (3): E73. doi:10.1371/journal.pbio.0020073. PMC 368168. PMID 15024422.
- ^ Rothemund PW (March 2006). “Folding DNA to create nanoscale shapes and patterns”. Nature 440 (7082): 297–302. Bibcode: 2006Natur.440..297R. doi:10.1038/nature04586. PMID 16541064.
- ^ Andersen ES, Dong M, Nielsen MM, Jahn K, Subramani R, Mamdouh W, Golas MM, Sander B, Stark H, Oliveira CL, Pedersen JS, Birkedal V, Besenbacher F, Gothelf KV, Kjems J (May 2009). “Self-assembly of a nanoscale DNA box with a controllable lid”. Nature 459 (7243): 73–76. Bibcode: 2009Natur.459...73A. doi:10.1038/nature07971. hdl:11858/00-001M-0000-0010-9362-B. PMID 19424153.
- ^ Ishitsuka Y, Ha T (May 2009). “DNA nanotechnology: a nanomachine goes live”. Nature Nanotechnology 4 (5): 281–82. Bibcode: 2009NatNa...4..281I. doi:10.1038/nnano.2009.101. PMID 19421208.
- ^ Aldaye FA, Palmer AL, Sleiman HF (September 2008). “Assembling materials with DNA as the guide”. Science 321 (5897): 1795–99. Bibcode: 2008Sci...321.1795A. doi:10.1126/science.1154533. PMID 18818351.
- ^ Dunn MR, Jimenez RM, Chaput JC (2017). “Analysis of aptamer discovery and technology”. Nature Reviews Chemistry 1 (10). doi:10.1038/s41570-017-0076 2022年6月30日閲覧。.
- ^ Wray GA (2002). “Dating branches on the tree of life using DNA”. Genome Biology 3 (1): REVIEWS0001. doi:10.1186/gb-2001-3-1-reviews0001. PMC 150454. PMID 11806830.
- ^ Panda D, Molla KA, Baig MJ, Swain A, Behera D, Dash M (May 2018). “DNA as a digital information storage device: hope or hype?”. 3 Biotech 8 (5): 239. doi:10.1007/s13205-018-1246-7. PMC 5935598. PMID 29744271.
- ^ Akram F, Haq IU, Ali H, Laghari AT (October 2018). “Trends to store digital data in DNA: an overview”. Molecular Biology Reports 45 (5): 1479–1490. doi:10.1007/s11033-018-4280-y. PMID 30073589.
- ^ Miescher F (1871). “Ueber die chemische Zusammensetzung der Eiterzellen [On the chemical composition of pus cells]” (ドイツ語). Medicinisch-chemische Untersuchungen 4: 441–60. "[p. 456] Ich habe mich daher später mit meinen Versuchen an die ganzen Kerne gehalten, die Trennung der Körper, die ich einstweilen ohne weiteres Präjudiz als lösliches und unlösliches Nuclein bezeichnen will, einem günstigeren Material überlassend. (Therefore, in my experiments I subsequently limited myself to the whole nucleus, leaving to a more favorable material the separation of the substances, that for the present, without further prejudice, I will designate as soluble and insoluble nuclear material ("Nuclein"))"
- ^ Dahm R (January 2008). “Discovering DNA: Friedrich Miescher and the early years of nucleic acid research”. Human Genetics 122 (6): 565–81. doi:10.1007/s00439-007-0433-0. PMID 17901982.
- ^ See:
- Kossel A (1879). “Ueber Nucleïn der Hefe [On nuclein in yeast]” (ドイツ語). Zeitschrift für physiologische Chemie 3: 284–91.
- Kossel A (1880). “Ueber Nucleïn der Hefe II [On nuclein in yeast, Part 2]” (ドイツ語). Zeitschrift für physiologische Chemie 4: 290–95.
- Kossel A (1881). “Ueber die Verbreitung des Hypoxanthins im Thier- und Pflanzenreich [On the distribution of hypoxanthins in the animal and plant kingdoms]” (ドイツ語). Zeitschrift für physiologische Chemie 5: 267–71.
- Kossel A (1881) (ドイツ語). Untersuchungen über die Nucleine und ihre Spaltungsprodukte [Investigations into nuclein and its cleavage products]. Strassburg, Germany. pp. 19
- Kossel A (1882). “Ueber Xanthin und Hypoxanthin [On xanthin and hypoxanthin]”. Zeitschrift für physiologische Chemie 6: 422–31.
- Albrect Kossel (1883) "Zur Chemie des Zellkerns" Archived 17 November 2017 at the Wayback Machine. (On the chemistry of the cell nucleus), Zeitschrift für physiologische Chemie, 7: 7–22.
- Kossel A (1886). “Weitere Beiträge zur Chemie des Zellkerns [Further contributions to the chemistry of the cell nucleus]” (ドイツ語). Zeitschrift für Physiologische Chemie 10: 248–64. "On p. 264, Kossel remarked presciently: Der Erforschung der quantitativen Verhältnisse der vier stickstoffreichen Basen, der Abhängigkeit ihrer Menge von den physiologischen Zuständen der Zelle, verspricht wichtige Aufschlüsse über die elementaren physiologisch-chemischen Vorgänge. (The study of the quantitative relations of the four nitrogenous bases—[and] of the dependence of their quantity on the physiological states of the cell—promises important insights into the fundamental physiological-chemical processes.)"
- ^ Jones ME (September 1953). “Albrecht Kossel, a biographical sketch”. The Yale Journal of Biology and Medicine 26 (1): 80–97. PMC 2599350. PMID 13103145.
- ^ Levene PA, Jacobs WA (1909). “Über Inosinsäure” (ドイツ語). Berichte der Deutschen Chemischen Gesellschaft 42: 1198–203. doi:10.1002/cber.190904201196.
- ^ Levene PA, Jacobs WA (1909). “Über die Hefe-Nucleinsäure” (ドイツ語). Berichte der Deutschen Chemischen Gesellschaft 42 (2): 2474–78. doi:10.1002/cber.190904202148.
- ^ Levene P (1919). “The structure of yeast nucleic acid”. J Biol Chem 40 (2): 415–24. doi:10.1016/S0021-9258(18)87254-4.
- ^ Cohen JS, Portugal FH (1974). “The search for the chemical structure of DNA”. Connecticut Medicine 38 (10): 551–52, 554–57. PMID 4609088.
- ^ Koltsov proposed that a cell's genetic information was encoded in a long chain of amino acids. See:
- Koltsov HK (12 December 1927). Физико-химические основы морфологии [The physical-chemical basis of morphology] (Speech). 3rd All-Union Meeting of Zoologist, Anatomists, and Histologists (ロシア語). Leningrad, U.S.S.R.
- Reprinted in: Koltsov HK (1928). “Физико-химические основы морфологии [The physical-chemical basis of morphology]” (ロシア語). Успехи экспериментальной биологии (Advances in Experimental Biology) series B 7 (1): ?.
- Reprinted in German as: Koltzoff NK (1928). “Physikalisch-chemische Grundlagen der Morphologie [The physical-chemical basis of morphology]” (ドイツ語). Biologisches Zentralblatt 48 (6): 345–69.
- In 1934, Koltsov contended that the proteins that contain a cell's genetic information replicate. See: Koltzoff N (October 1934). “The structure of the chromosomes in the salivary glands of Drosophila”. Science 80 (2075): 312–13. Bibcode: 1934Sci....80..312K. doi:10.1126/science.80.2075.312. PMID 17769043. "From page 313: "I think that the size of the chromosomes in the salivary glands [of Drosophila] is determined through the multiplication of genonemes. By this term I designate the axial thread of the chromosome, in which the geneticists locate the linear combination of genes; … In the normal chromosome there is usually only one genoneme; before cell-division this genoneme has become divided into two strands.""
- ^ Soyfer VN (September 2001). “The consequences of political dictatorship for Russian science”. Nature Reviews Genetics 2 (9): 723–29. doi:10.1038/35088598. PMID 11533721.
- ^ Griffith F (January 1928). “The Significance of Pneumococcal Types”. The Journal of Hygiene 27 (2): 113–59. doi:10.1017/S0022172400031879. PMC 2167760. PMID 20474956.
- ^ Lorenz MG, Wackernagel W (September 1994). “Bacterial gene transfer by natural genetic transformation in the environment”. Microbiological Reviews 58 (3): 563–602. doi:10.1128/MMBR.58.3.563-602.1994. PMC 372978. PMID 7968924.
- ^ Brachet J (1933). “Recherches sur la synthese de l'acide thymonucleique pendant le developpement de l'oeuf d'Oursin” (イタリア語). Archives de Biologie 44: 519–76.
- ^ Burian R (1994). “Jean Brachet's Cytochemical Embryology: Connections with the Renovation of Biology in France?”. Les sciences biologiques et médicales en France 1920–1950. Cahiers pour I'histoire de la recherche. 2. Paris: CNRS Editions. pp. 207–20
- ^ See:
- Astbury WT, Bell FO (1938). “Some recent developments in the X-ray study of proteins and related structures”. Cold Spring Harbor Symposia on Quantitative Biology 6: 109–21. doi:10.1101/sqb.1938.006.01.013. オリジナルの14 July 2014時点におけるアーカイブ。.
- Astbury WT (1947). “X-ray studies of nucleic acids”. Symposia of the Society for Experimental Biology (1): 66–76. PMID 20257017. オリジナルの5 July 2014時点におけるアーカイブ。.
- ^ Avery OT, Macleod CM, McCarty M (February 1944). “Studies on the Chemical Nature of the Substance Inducing Transformation of Pneumococcal Types: Induction of Transformation by a Desoxyribonucleic Acid Fraction Isolated from Pneumococcus Type III”. The Journal of Experimental Medicine 79 (2): 137–158. doi:10.1084/jem.79.2.137. PMC 2135445. PMID 19871359.
- ^ Chargaff E (June 1950). “Chemical specificity of nucleic acids and mechanism of their enzymatic degradation”. Experientia 6 (6): 201–209. doi:10.1007/BF02173653. PMID 15421335.
- ^ Kresge N, Simoni RD, Hill RL (June 2005). “Chargaff's Rules: the Work of Erwin Chargaff”. Journal of Biological Chemistry 280 (24): 172–174. doi:10.1016/S0021-9258(20)61522-8.
- ^ Hershey AD, Chase M (May 1952). “Independent functions of viral protein and nucleic acid in growth of bacteriophage”. The Journal of General Physiology 36 (1): 39–56. doi:10.1085/jgp.36.1.39. PMC 2147348. PMID 12981234.
- ^ “Pictures and Illustrations: Crystallographic photo of Sodium Thymonucleate, Type B. "Photo 51." May 1952”. scarc.library.oregonstate.edu. 2023年5月18日閲覧。
- ^ Schwartz J (2008). In pursuit of the gene: from Darwin to DNA. Cambridge, Mass.: Harvard University Press. ISBN 978-0-674-02670-4
- ^ Pauling L, Corey RB (February 1953). “A Proposed Structure For The Nucleic Acids”. Proceedings of the National Academy of Sciences of the United States of America 39 (2): 84–97. Bibcode: 1953PNAS...39...84P. doi:10.1073/pnas.39.2.84. PMC 1063734. PMID 16578429.
- ^ Regis E (2009). What Is Life?: investigating the nature of life in the age of synthetic biology. Oxford: Oxford University Press. p. 52. ISBN 978-0-19-538341-6
- ^ “Double Helix of DNA: 50 Years”. Nature Archives. 2015年4月5日時点のオリジナルよりアーカイブ。2007年2月15日閲覧。
- ^ “Original X-ray diffraction image”. Oregon State Library. 2009年1月30日時点のオリジナルよりアーカイブ。2011年2月6日閲覧。
- ^ “The Nobel Prize in Physiology or Medicine 1962”. Nobelprize.org. 2006年12月24日閲覧。
- ^ Burakoff M (2023年4月25日). “Rosalind Franklin's role in DNA discovery gets a new twist”. AP News 2023年4月25日閲覧。
- ^ Anthes E (2023年4月25日). “Untangling Rosalind Franklin's Role in DNA Discovery, 70 Years On – Historians have long debated the role that Dr. Franklin played in identifying the double helix. A new opinion essay argues that she was an "equal contributor."”. The New York Times. オリジナルの2023年4月25日時点におけるアーカイブ。 2023年4月26日閲覧。
- ^ Cobb M, Comfort N (25 April 2023). “What Rosalind Franklin truly contributed to the discovery of DNA's structure – Franklin was no victim in how the DNA double helix was solved. An overlooked letter and an unpublished news article, both written in 1953, reveal that she was an equal player.”. Nature 616 (7958): 657–660. doi:10.1038/d41586-023-01313-5. PMID 37100935.
- ^ Maddox B (January 2003). “The double helix and the 'wronged heroine'”. Nature 421 (6921): 407–08. Bibcode: 2003Natur.421..407M. doi:10.1038/nature01399. PMID 12540909. オリジナルの17 October 2016時点におけるアーカイブ。.
- ^ Crick FH (1955). A Note for the RNA Tie Club (PDF) (Speech). Cambridge, England. 2008年10月1日時点のオリジナル (PDF)よりアーカイブ.
- ^ Meselson M, Stahl FW (July 1958). “The Replication of DNA in Escherichia Coli”. Proceedings of the National Academy of Sciences of the United States of America 44 (7): 671–82. Bibcode: 1958PNAS...44..671M. doi:10.1073/pnas.44.7.671. PMC 528642. PMID 16590258.
- ^ “The Nobel Prize in Physiology or Medicine 1968”. Nobelprize.org. 2006年12月24日閲覧。
- ^ Pray L (2008). “Discovery of DNA structure and function: Watson and Crick.”. Nature Education 1 (1): 100.
- ^ Panneerchelvam S, Norazmi MN (2003). “Forensic DNA Profiling and Database”. The Malaysian Journal of Medical Sciences 10 (2): 20–26. PMC 3561883. PMID 23386793.
推薦文献
- 田村隆明『基礎細胞生物学』(第1版第1刷版)、東京化学同人、2010年。ISBN 978-4-8079-0724-3。
- 武村政春『DNAを操る分子たち』(初版第1刷版)、技術評論社、2012年。ISBN 978-4-7741-4998-1。
- Berry A, Watson J (2003年). DNA: the secret of life. New York: Alfred A. Knopf. ISBN 0-375-41546-7.
-
Calladine CR, Drew HR, Luisi BF, Travers AA (2003年). Understanding DNA: the molecule & how it works. Amsterdam: Elsevier Academic Press. ISBN 0-12-155089-3.
{{cite book2}}: CS1メンテナンス: 複数の名前/author (カテゴリ) - Carina D, Clayton J (2003年). 50 years of DNA. Basingstoke: Palgrave Macmillan. ISBN 1-4039-1479-6.
- Judson HF [英語版] (1979年). The Eighth Day of Creation: Makers of the Revolution in Biology (2nd ed.). Cold Spring Harbor Laboratory Press. ISBN 0-671-22540-5.
- Olby RC [英語版] (1994年). The path to the double helix: the discovery of DNA. New York: Dover Publications. ISBN 0-486-68117-3. First published in October 1974 by MacMillan, with foreword by Francis Crick; the definitive DNA textbook, revised in 1994 with a nine-page postscript.
-
Olby R (2003年1月). “Quiet debut for the double helix”. Nature. 421 (6921): 402–05. Bibcode:2003Natur.421..402O. doi:10.1038/nature01397. PMID 12540907.
{{cite journal2}}: CS1メンテナンス: authors引数 (カテゴリ) - Olby RC (2009年). Francis Crick: A Biography. Plainview, N.Y: Cold Spring Harbor Laboratory Press. ISBN 978-0-87969-798-3.
- Micklas D (2003年). DNA Science: A First Course. Cold Spring Harbor Press. ISBN 978-0-87969-636-8.
- Ridley M [英語版] (2006年). Francis Crick: discoverer of the genetic code. Ashland, OH: Eminent Lives, Atlas Books. ISBN 0-06-082333-X.
- Rosenfeld I (2010年). DNA: A Graphic Guide to the Molecule that Shook the World. Columbia University Press. ISBN 978-0-231-14271-7.
- Schultz M, Cannon Z (2009年). The Stuff of Life: A Graphic Guide to Genetics and DNA. Hill and Wang. ISBN 978-0-8090-8947-5.
- Stent GS, Watson J [英語版] (1980年). The Double Helix: A Personal Account of the Discovery of the Structure of DNA. New York: Norton. ISBN 0-393-95075-1.
- Watson J (2004年). DNA: The Secret of Life. Random House. ISBN 978-0-09-945184-6.
- Wilkins M [英語版] (2003年). The third man of the double helix the autobiography of Maurice Wilkins. Cambridge, England: University Press. ISBN 0-19-860665-6.
外部リンク
| DNAに関する 図書館収蔵著作物 |
- 蛋白質構造データバンク 今月の分子23:DNA(DNA)
- DNAを学ぼう(かずさDNA研究所)- 「DNA入門(DNA from the Beginning 日本語版)」や、世界の研究におけるトピックなど。
- 遺伝学電子博物館(国立遺伝学研究所)- DNAを含む遺伝学のトピック、歴史など。
DNA(ディーエヌエー)
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2021/08/13 17:53 UTC 版)
「メタルファイト ベイブレード ZEROG」の記事における「DNA(ディーエヌエー)」の解説
破山 キラ(はやま キラ) 声 - 細谷佳正 使用ベイブレード - バーサーカーベギラドスSR200BWD(ベヒーモス)、ゴレイムベギラドスSR200BWD、グラディエーターバハムディアSP230GF(バハムート)、ペガシスバハムディアSP230R2F、ベギラドスゴレイムDF145BS WBBAに対抗するために立ち上げられた組織「DNA」の一員で、岩山の上司にあたる少年。DNAの中でも最強の実力を誇るブレーダーである。髪を3色に色分けし、眼帯を着け露出の多い衣装に身を包んでいる。冷酷非道な人物であり、ゼロに敗れた岩山に制裁を加え、バトルを挑んだ忍を撃破する。 WBBAのコンピューターにハッキングをして翼とまどかを通じてゼロに宣戦布告をし、また翼が極秘に企画していた全国大会「ネオ・バトルブレーダーズ」の情報までも掴んでいる。ゼロとのバトルではゴレイムベギラドスに圧倒的に有利な広面積の変則形状スタジアムで勝負を挑み、ゼロに卑怯者と罵られるものの作戦の内だと一蹴し、ゼロを撃破する。 ネオ・バトルブレーダーズでは予選でエイトを撃破して決勝トーナメントに進出し、1回戦第2試合でカイトに勝利する。 アルゴたちから全幅の信頼を寄せられているものの、彼自身はアルゴたちに忠誠を誓ってはおらず、ベギラドスのスタミナだけでゼロたちに勝てると思い込んでいるアルゴたちを心の底では軽蔑している。後にスタミナのみを特化したベギラドスに限界を感じ、アルゴたちには内緒でメルシーに作らせていたバハムディアに乗り換え、準決勝第2試合で忍を撃破する。決戦前にはアルゴたちに見切りを付け、彼らに代わってベイブレード界の支配を宣言するが、決勝戦でゼロに敗北する。その後ゼロに声をかけられるも、素っ気ない態度を見せて会場を後にした。 その後、バイフーが銀河から奪ってきたペガシスとバハムディアをシンクロームしてペガシスバハムディアを完成。他のメンバーと共に第二次メンバー選抜大会を襲撃すべく姿を現し、ゼロとの再戦の際に圧倒的な力を見せつけリベンジを果たす。 DNA本部では空中スタジアムでゼロにシンクロームバトルで挑み、自分のプライドのために戦うが敗北。試合後にスタジアムのフロートシステムが故障し落下しかけるが、ゼロと岩山に助けられる。そして岩山からベギラドスゴレイムを受け取り、ゼロ、銀河と共に大道寺を倒す。DNA壊滅後は改心し、他の元DNAのブレーダーたちと共に「ブリッジ・トゥ・ザ・フューチャー」を結成してゼロたち日本代表チームを相手に日本代表の座を賭けて戦う。 ベギラドスの開発段階での名称はペギラドスで、彼の名前の由来はペギー葉山とキラー。また、名前の意味は「殺し、破壊する」。服装のデザインはHBKから。初期デザインはキラと岩山は2人ともレスラー風だったため、差別化するためにキラは中性的なボンデージにデザインされた。(漫画版) 新生ダークネビュラの一員で、岩山と共にネオバトルブレーダーズに出場する。2回戦のバトルロイヤルでカイトを破り、準決勝のバトル中に誕生したバハムディアの力で忍を破った直後にスタジアムを破壊して全てを消し去ろうとするが、止めに入ったゼロとそのままバトルを始める。かつてその服装とベイの強さから周囲から疎まれていたために全てのベイとブレーダーを憎んでおり、その恨みをゼロにぶつけようとするが、仲間とのバトルを通じて強くなったゼロの究極必殺転技に敗れる。敗北後は大道寺にも見捨てられて自暴自棄になるが、ゼロに仲間だと認められて涙を流す。1年後の大会では準決勝でゼロと再戦を果たしている。 眼帯にはベイの回転数や相手ブレーダーの心拍数などが分かる機能が付いている。元々ベギラドスだけのブレーダーでバハムディア使いは別に登場予定だったが、キラがベイを進化させたことで出番がなくなった。 彼が使用するバーサーカーベギラドスはスタミナタイプのベイで、大きなクリスタルウィールとクロムウィールに付けられた鉄球と鎖が外重心となって強力な遠心力を生み出す。漫画版では最凶の攻撃力を誇るベイと呼ばれ、超硬質の素材でできたウィールにより触れたものを切り刻む。またベギラドスは「卵」であり、熱いベイバトルで温まることで中から真の姿であるバハムディアが誕生する。 ゴレイムベギラドスはクロムウィールが完全な円形となり、驚異的なスタミナと防御力を発揮するだけでなく、ウィールの凹凸を完全に無くすことで相手の攻撃を完全に受け流すことができる。 グラディエーターバハムディアはベイブレード史上最大級のクロムウィールの大きさを誇り、クリスタルウィールの4本の剣によって攻撃と防御を同時にこなすことができる。また、スパイク230トラックに付いた鉤爪状のスパイクでブレーキをかけることによってスタジアムアウトによる自滅を防ぐことが可能。さらに桁外れの回転力によって地震のような超振動を起こすこともできる。 ペガシスバハムディアはバハムディアとペガシスの力を一つにしたベイであり、今までのベイには無い圧倒的な力を持つ。 必殺転技は「アイアンブレイブ」、「ガイアハンマー」、「グラディエーターデモリッション」、「ファイナルアルティメットデモリッション」、「ライジングガイアハンマー」。 絶滅転技は「ジ・エンド」(漫画版)、「ファイナル ジ・エンド」(漫画版)。 岩山 美男(いわやま よしお) 声 - 大畑伸太郎 使用ベイブレード - バンディッドゴレイムDF145BS(ゴーレム)、ベギラドスゴレイムDF145BS 自らを「ディフェンス最強の男」と称する、屈強な腕と大きな顔の巨漢。上司であるキラを慕っている。カイトが最強のディフェンスタイプの使い手であるという噂を聞きつけ、打倒カイトのためにベイパークへと訪れた。相手のベイがボロボロになるまでバトルを止めない主義であり、彼によって多くのブレーダーたちがベイを傷つけられることとなる。 カイトを探してベイパークを荒らし回っていた所へ駆けつけたエイトとバトルをし、エイトのオロジャを傷付けて勝利する。その後、エイトの敵討ちに挑んだカイトも破り、悪矢にも圧倒的な力で撃破するが、特訓を積んだゼロに敗北する。 ネオ・バトルブレーダーズでは予選大会でリベンジを果たそうとする悪矢を撃破して決勝トーナメントに進むが、1回戦第1試合で忍に敗北する。他のDNAメンバーと違い、キラがグレイシーズを裏切った後も最後まで彼に付き従っている。 その後は精鋭部隊と共にゼロたちのベイパークを襲撃し、日本代表の第二次メンバー選抜大会を襲撃するもゼロと戦い敗北。 ゼロたちのDNA本部突入時には、キラから譲り受けたベギラドスウィールをシンクロームさせたベギラドスゴレイムを使用し、変則形状スタジアムでゼロに勝負を挑んで追い詰めるが、途中でゼロと交代した左京とのシンクロームバトルで敗れる。その後空中スタジアムから落下しかけたゼロとキラを救い、大道寺との決着の際はキラにベギラドスゴレイムを受け渡す。(漫画版) キラと共にネオバトルブレーダーズに出場する。2回戦のバトルロイヤルで蓮と木倉ゲンをまとめて倒すが、ゼロに必殺転技を破られ敗北する。 彼が使用するバンディッドゴレイムは典型的なディフェンスタイプのベイで、鎧に覆われた台形のウィールが相手の攻撃を弾き返し、攻撃時にはそのウィールの厚みと重さが強力な破壊力を生み出す。また、ダウンフォース145トラックによって驚異的なダウンフォースを生み出し、相手のベイを吸い込むこともできる。漫画版では最硬の防御力を持つベイと呼ばれ、ベギラドスと同じ超硬質の素材でできたウィールにより触れたものを粉々にする。 ベギラドスゴレイムは、ゴレイムベギラドスと同様にウィールの凹凸を無くすことでもともと高い防御力をさらに高めている。 必殺転技は「大爆掌」(漫画版)。 亀垣 玄十郎(かめがき げんじゅうろう) 声 - 木村良平 使用ベイブレード - バンディッドゲンブルF230TB(玄武) アニメオリジナルキャラクター。アルゴがネオ・バトルブレーダーズに送り込んだDNAの刺客の1人。星柄をあしらった衣装を着ていて、楊枝をくわえている。武士道精神に溢れ、会話の際に語尾に「ござる」を付けて話す。 予選大会で蓮を撃破するが、キラを優勝させるためなら自分は捨て駒になっても構わないと公言したことで、「ベイバトルを舐めている」と左京の怒りを買い、たったの一撃で敗北。決勝トーナメントには進出できなかった。 その後は各地のベイパークを襲撃し、日本代表の第二次メンバー選抜大会を襲撃するも蓮と再戦し敗北。 ゼロたちのDNA本部突入時には、ガラスで覆われたバトルフィールドで忍の戦法を封じ追い詰めるが、機転によりガラスを破壊され敗北する。 彼が使用するバンディッドゲンブルはフリー回転するフリー230トラックで相手の攻撃を受け流し、またツインボールボトムによってZEROGスタジアムの急激な揺れにも振り回されない安定度を誇る。 必殺転技は「甲破轟転撃」。 スパイクボーン 声 - 最上嗣生 使用ベイブレード - シーフジラーゴWA130HF(麒麟) アニメオリジナルキャラクター。アルゴがネオ・バトルブレーダーズに送り込んだDNAの刺客の1人で、顔に大きな十字傷を持つ。非常に好戦的な性格をしており、ボクシングに似たスタイルでバトルを行う。DNAが育てたブレーダーの中では最も狂暴で、一度暴れ出したらどちらかが完全にノックダウンするまで打ち合うことをやめない。 勝敗を度外視してまでゼロのイフレイドに損傷を負わせるというアルゴからの命を受け、ゼロと鷹ノ助がバトルをしようとした所へ突然乱入し、無理矢理ゼロに勝負を挑むが敗北。決勝トーナメントには進出できなかった。 その後は各地のベイパークを襲撃し、日本代表の第二次メンバー選抜大会を襲撃するも忍の一撃に吹き飛ばされ、アローの技に巻き込まれる。 ゼロたちのDNA本部突入時にはアローと共に特殊な電磁波でエイトと蓮を追い詰めるが、合流した左京と鷹ノ助に敗れる。 彼が使用するシーフジラーゴはアタックタイプのベイで、強力な連打攻撃を得意とする。クロムウィールに刻まれた2匹の麒麟とナイフのような鋭い刃で、1度のアタックで多くのダメージを相手に刻み込み、アタックされるたびに相手に確実にダメージを蓄積させていくことが可能。 キャプテン・アロー 声 - 成瀬誠 使用ベイブレード - アーチャーワイヴァング145WB(ワイバーン) アニメオリジナルキャラクター。アルゴがネオ・バトルブレーダーズに送り込んだDNAの刺客の1人で、顔に仮面をつけた少年。自らを愛と友情の戦士と称する正義のヒーローかぶれで、DNAのブレーダーの中でも最もお調子者と呼ばれる。「正義」と言いつつも、卑怯な手段を臆面もなく使う。 予選大会を突破し1回戦第3試合で左京と対戦。キョウヤの獅子暴風壁と似た技を使うが、左京に「風の中に隠れなければ何もできない臆病者」と罵られ、たったの一撃で敗北する。 その後は各地のベイパークを襲撃し、日本代表の第二次メンバー選抜大会を襲撃し、参加者などのベイを技で吹き飛ばすもスパイクのジラーゴの巻き添えを喰らう。 ゼロたちのDNA本部突入時にはスパイクと共に特殊な電磁波でエイトと蓮を追い詰めるが、合流した左京と鷹ノ助に敗れる。 彼が使用するアーチャーワイヴァングは、翼のようなクロムウィールで空気を巻き込みトルネードを発生させることができる。 必殺転技は「アロートルネード」、「トルネードアタック」。 アルゴ・グレイシー 声 - 楠大典 前作から再登場。DNAの創始者で、兄弟で結成されたチームグレイシーズの長男。かつて弟たちと共にベイブレード世界大会に出場するが、翼たち日本チームに敗れる。その後、ネメシスクライシス事件でのどさくさに紛れてハデスインクが所有していた資産やデータを掻き集め、それを元手に自分たちを陥れた翼たちへの復讐のために兄弟でDNAを結成する。また、かつてダークネビュラが運用していたスーパーコンピューター「メルシー」の鹵獲も行い、データ分析のために有効活用している。厳重なセキュリティが施されたWBBAのコンピューターにキラたちが容易にハッキングできたのは、このメルシーの驚異的な分析能力の恩恵があったからである。 しかしネオ・バトルブレーダーズの決勝大会にて、キラの裏切りに粛清をかけるも返り討ちに遭い、決勝戦の間は弟たちと共に小部屋に閉じ込められる。その後DNAのリーダーとなったキラの言うことを渋々聞くようになり、自分たちの待遇改善と引き換えにゼロたちのDNA本部突入を防ぐことに加担する。 しかし大道寺の暴走によって本部が崩れ始めたため、兄弟と共に早々と脱出した(本人たちは戦略的撤退ということにしている)。 長森佳容によると、年齢は20半ば手前。 アイアン・グレイシー 声 - 遠藤大輔 DNAの幹部の1人で、グレイシーズの次男。7年前とは違い、眼鏡を着用している。 セレン・グレイシー 声 - 鹿野優以 DNAの幹部の1人で、グレイシーズの長女。アルゴとアイアンの妹でエンソの姉。 エンソ・グレイシー 声 - 伊東みやこ DNAの幹部の1人で、グレイシーズの三男。7年前と比べて背が伸びたが、口癖は変わらず「すごいねー」である。 メルシー 声 - 平田広明 DNAの頭脳となるコンピューター。ハデスインクのシステムを完璧に使いこなすことからグレイシーズが復活させ、彼らから重宝される。 後にハデスインクのコンピューターネットワークに移植された大道寺の精神と同調しており、グレイシーズの従順なしもべのふりをしつつダークネビュラ復活の旗手となるブレーダーの育成と最強のベイ開発を秘密裏に進めていたことが明かされる。
※この「DNA(ディーエヌエー)」の解説は、「メタルファイト ベイブレード ZEROG」の解説の一部です。
「DNA(ディーエヌエー)」を含む「メタルファイト ベイブレード ZEROG」の記事については、「メタルファイト ベイブレード ZEROG」の概要を参照ください。
「DNA」の例文・使い方・用例・文例
- ヘリカーゼの役割はDNAの解ねんである。
- 彼は形質転換されなかった細胞からDNAを抽出した。
- 新しいDNA証拠が出たのでその事件は再捜査中である。
- ゲノムのDNAの数
- 2本の鎖からなるDNA
- 組み換え DNA.
- DNAは私たちの遺伝子の物質である
- 識別の目的で人の体組織または体液のサンプルでDNAを分析する手順
- 同じまたは近縁種の別の細胞からDNAを導入することによって(細菌性細胞を)遺伝学的に異なる細胞に変える
- 外来性DNAの摂取や合併による細胞またはバクテリアの一時的変異
- (DNAのらせん構造)にある遺伝情報をRNA、特にメッセンジャーRNAのらせん構造に変換する
- 科学者はDNAを組み変えるべきであるか
- DNAは再結合できる
- 1つの細胞に通常のDNA量を有する有機体または細胞
- 人間のb型肝炎を引き起こすウイルスと同様に、カモ、ウッドチャックそしてリスとその他のウイルスを含む動物のDNAの群
- 1ビリオンあたり2つの単一らせん構造の線状RNA分子と(RNAからDNAへの)逆転写酵素から成るウイルスのグループの総称
- 20面体のタンパク質の殻の中にDNAを含み、犬と牛の疾患を引き起こす一群のウイルスの総称
- DNAを細胞へ運ぶのに使用されるさまざまな他の媒介物
- 非反復的なDNA配列
- 既知のDNAまたは遺伝子配列に関して染色体の特定の領域に配置する
固有名詞の分類
- DNAのページへのリンク