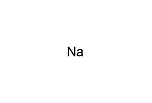人体に必要なミネラルの一種で、主に食塩(塩化ナトリウム)の形で摂取されています。
成人の体内には、ほとんどが細胞の外の体液(細胞外液)に含まれています。細胞外液の浸透圧を調節し、細胞外液量を保つなどの役割をしています。
通常、健康な人では欠乏することはありません。摂りすぎるとむくみや口の渇きのほか、高血圧、胃がん、食道がんのリスクを高めることが報告されています。本来必要な1日の摂取量は2、3g程度ですが、塩味の好みは習慣的なもので、個人差も大きく、つい摂りすぎてしまいがちです。カリウムを多く含む野菜や果物を一緒に摂ることで、ナトリウムの排泄を促進することができます。「日本人の食事摂取基準(2005年版)」では、摂取量の減少を目指すものと位置づけられており、目標量(食塩として)は成人男性で1日当たり10g未満、成人女性では8g未満と設定されています。
ナトリウム【(ドイツ)Natrium】
ナトリウム
ナトリウム(Na)
ナトリウム
【英】:Na
ナトリウム
ナトリウム
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/04/28 05:07 UTC 版)
|
|||||||||||||||||||||||||||||
| 外見 | |||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
銀白色  ナトリウムのスペクトル線 |
|||||||||||||||||||||||||||||
| 一般特性 | |||||||||||||||||||||||||||||
| 名称, 記号, 番号 | ナトリウム, Na, 11 | ||||||||||||||||||||||||||||
| 分類 | アルカリ金属 | ||||||||||||||||||||||||||||
| 族, 周期, ブロック | 1, 3, s | ||||||||||||||||||||||||||||
| 原子量 | 22.98976928(2) | ||||||||||||||||||||||||||||
| 電子配置 | [Ne] 3s1 | ||||||||||||||||||||||||||||
| 電子殻 | 2,8,1(画像) | ||||||||||||||||||||||||||||
| 物理特性 | |||||||||||||||||||||||||||||
| 相 | 固体 | ||||||||||||||||||||||||||||
| 密度(室温付近) | 0.968 g/cm3 | ||||||||||||||||||||||||||||
| 融点での液体密度 | 0.927 g/cm3 | ||||||||||||||||||||||||||||
| 融点 | 370.87 K, 97.72 °C, 207.9 °F | ||||||||||||||||||||||||||||
| 沸点 | 1156 K, 883 °C, 1621 °F | ||||||||||||||||||||||||||||
| 臨界点 | (推定)2573 K, 35 MPa | ||||||||||||||||||||||||||||
| 融解熱 | 2.60 kJ/mol | ||||||||||||||||||||||||||||
| 蒸発熱 | 97.42 kJ/mol | ||||||||||||||||||||||||||||
| 熱容量 | (25 °C) 28.230 J/(mol·K) | ||||||||||||||||||||||||||||
| 蒸気圧 | |||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||
| 原子特性 | |||||||||||||||||||||||||||||
| 酸化数 | +1, 0, −1 (強塩基性酸化物) |
||||||||||||||||||||||||||||
| 電気陰性度 | 0.93(ポーリングの値) | ||||||||||||||||||||||||||||
| イオン化エネルギー | 第1: 495.8 kJ/mol | ||||||||||||||||||||||||||||
| 第2: 4562 kJ/mol | |||||||||||||||||||||||||||||
| 第3: 6910.3 kJ/mol | |||||||||||||||||||||||||||||
| 原子半径 | 186 pm | ||||||||||||||||||||||||||||
| 共有結合半径 | 166±9 pm | ||||||||||||||||||||||||||||
| ファンデルワールス半径 | 227 pm | ||||||||||||||||||||||||||||
| その他 | |||||||||||||||||||||||||||||
| 結晶構造 | 体心立方構造 | ||||||||||||||||||||||||||||
| 磁性 | 常磁性 | ||||||||||||||||||||||||||||
| 電気抵抗率 | (20 °C) 47.7 nΩ⋅m | ||||||||||||||||||||||||||||
| 熱伝導率 | (300 K) 142 W/(m⋅K) | ||||||||||||||||||||||||||||
| 熱膨張率 | (25 °C) 71 μm/(m⋅K) | ||||||||||||||||||||||||||||
| 音の伝わる速さ (微細ロッド) |
(20 °C) 3200 m/s | ||||||||||||||||||||||||||||
| ヤング率 | 10 GPa | ||||||||||||||||||||||||||||
| 剛性率 | 3.3 GPa | ||||||||||||||||||||||||||||
| 体積弾性率 | 6.3 GPa | ||||||||||||||||||||||||||||
| モース硬度 | 0.5 | ||||||||||||||||||||||||||||
| ブリネル硬度 | 0.69 MPa | ||||||||||||||||||||||||||||
| CAS登録番号 | 7440-23-5 | ||||||||||||||||||||||||||||
| 主な同位体 | |||||||||||||||||||||||||||||
| 詳細はナトリウムの同位体を参照 | |||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||
ナトリウム(独: Natrium [ˈnaːtriʊm]、羅: Natrium)は、原子番号11の元素、およびその単体金属のことである。ソジウム(ソディウム、英: sodium [ˈsoʊdiəm])、ソーダ(曹達)ともいう。元素記号Na。原子量22.99。アルカリ金属元素、典型元素のひとつ。
名称
ナトリウムという名称は、天然炭酸ソーダを意味するギリシャ語の νίτρον[2]、あるいはラテン語の natron(ナトロン)[3]に由来するといわれている。
ドイツ語では Natrium、英語では sodium と呼ばれる。いずれも近代にラテン語として造語された単語である(現代ラテン語では natrium が使われる)。日本ではドイツ語から輸入され、ナトリウムという名称が定着した。元素記号はドイツ語からNaになった一方、IUPAC名は英語から sodium とされている。
日本では、医薬学や栄養学などの分野でソジウム(ソディウム、英: sodium [ˈsoʊdiəm])ともいう。工業分野では(特に化合物中において)ソーダ(曹達)と呼ばれている[注釈 1]。
歴史
1807年、ハンフリー・デービーが水酸化ナトリウム(苛性ソーダ)を電気分解することにより発見した。
危険性
毒物および劇物取締法により劇物に指定されている[4]。
消防法第2条第7項及び別表第一第3類1号により第3類危険物に指定されている。
鉛ビスマス合金ほどではないにせよ溶解、あるいはナトリウム中の不純物により金属容器を腐食することがあるので、冷却材として用いる際はこれら化学的な腐食による漏出に注意する必要が有る。[5]
| ナトリウム | |
|---|---|
| 危険性 | |
| GHSピクトグラム |   |
| GHSシグナルワード | 危険(DANGER) |
| Hフレーズ | H260, H314 |
| Pフレーズ | P223, P231+232, P280, P305+351+338, P370+378, P422[6] |
| EU分類 |  F F C C |
| EU Index | Danger |
| NFPA 704 | |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
単体
性質
常温、常圧での結晶構造は、BCC構造(体心立方構造)。融点は98 °Cで、沸点は883 °C。比重は0.97で、わずかに水より軽い。
非常に反応性の高い金属で、酸、塩基に侵され、水と激しく反応し、水酸化ナトリウムとなり水素も放出するため、空気中の酸素と水素が混ざり合った後に反応熱によって点火されると、爆発することもある。水と反応すると下記に示される化学反応過程を経て水酸化ナトリウムになるため、素手で触ると、手の表面にある水分と化合し、水酸化ナトリウムとなって皮膚を侵す。さらに空気中で容易に酸化されるため、天然には金属ナトリウム単体は存在しない。保存する際は灯油に浸ける。後述の化学反応に示すように、アルコールなどのプロトン溶媒とも反応するがエーテルや灯油とは反応しないため、灯油などを保存液体として使用する。イオン化する時は一価の陽イオンになりやすい。炎色反応で黄色を呈する。
200 GPa(約200万気圧)の高圧下では、結晶構造が変化し、金属光沢を失い透明になる[7]。
生産
水酸化物や塩化物を融解塩電解することによって単体を得られる。カストナー法(原料NaOH)、ダウンズ法(原料NaCl)が知られる。海外ではフランスのMAAS社とアメリカのDuPont社がダウンズ法で生産している[8]。日本の輸入量は2007年で3055トンであった[9]。またカストナー法は工業生産としては使用されていない。
用途
熱伝導率がよく、高温でも液体で存在するため、単体としては高速増殖炉の冷却材として用いられる。融点が低いため、エンジンの排気バルブのステムを中空にして部分的にナトリウムを封入し、バルブ動作に伴う溶融ナトリウムの運動によりバルブヘッドを冷却する用途にも使われる。そのほかに、負極にナトリウム、正極に硫黄を使ったNaS電池がある。これは大型の非常用電源や、風力発電のエネルギー貯蔵に利用される。トンネルの中などに使われている発光(ナトリウムのD線、D1:589.6 nmとD2:589.0 nm)はナトリウムランプである。二本に分裂するのは3p軌道のスピン軌道相互作用によるものである。
生体にとっては重要な電解質のひとつであり、ヒトではその大部分が細胞外液に分布している。神経細胞や心筋細胞などの電気的興奮性細胞の興奮には、細胞内外のナトリウムイオン濃度差が不可欠である。細胞外濃度は135–145 mol/m3程度に保たれており、細胞外液の陽イオンの大半を占める。そのため、ナトリウムイオンの過剰摂取は濃度維持のための水分貯留により、高血圧の大きな原因となる。
おもな化学反応
- ナトリウムの特性 - 原子力百科事典 ATOMICA)
- ナトリウム冷却システム 同
- ナトリウム取扱い技術 同
- ナトリウムの安全性(1次系ナトリウム) 同
- ナトリウムの安全性(蒸気発生器および2次系ナトリウム) 同
- ナトリウム - (オレゴン州大学・ライナス・ポーリング研究所)
- ナトリウム - 素材情報データベース<有効性情報>(国立健康・栄養研究所)
- 国際化学物質安全性カード ナトリウム (ICSC:0717) 日本語版(国立医薬品食品衛生研究所による), 英語版
- 『ナトリウム』 - コトバンク
- Alkali metals in water ( Not the braniac version ) - YouTube - ナトリウムと水の反応動画
- ナトリウム (試薬) JISK8687:2011
ナトリウム
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2021/10/10 04:16 UTC 版)
ナトリウムは一部の植物にとっての必須または有用要素であり、植物一般の必須栄養素ではない。要求性の植物は、CAM型光合成やC4型光合成を行うものの中の、NAD-ME型とPEP-CK型である。例としてヒエEchinochloa utilis、ギョウギシバCynodon dactylon、Kyllinga brevifolia、ハゲイトウAmaranthus tricolor L.、Kochia childsii、マツバボタンPortulaca grandiflora、アフリカヒゲシバChloris gayana、キビPanicum miliaceum、ギニアグラスPanicum maximum、Panicum coloratum、オオクサキビPanicum dichotomiflorumがあり、培養液からナトリウムが除かれると枯死する。これらの植物においてナトリウムは、ピルビン酸を葉肉細胞の葉緑体へと供給する際に必要とされる。すなわち、NAD-ME型とPCK型ではピルビン酸はナトリウムとの共輸送により運搬される。一方で、NADP-ME型C4植物ではピルビン酸輸送にナトリウムを必須としない。葉緑体でピルビン酸はホスホエノールピルビン酸合成の基質になる。このほか、要求性植物ではナトリウムは光化学系IIの活性および、葉肉葉緑体の超微細構造変化の抑制に用いられる。 ナトリウムは一部の作物の生育と品質を向上させることが実証されている。例えば、ニンジンのスクロース濃度が増加する。理由はよくわかっていないが、アカザ科にはナトリウムを好む植物が多い。アカザ科のテンサイでは、カリウムが十分に施用されている場合においてもナトリウムにより生育は促進される。ドイツや北海道ではチリ硝石(硝酸ナトリウム)がよく施用される。 ナトリウムは、浸透圧調節、気孔の開閉の調節、光合成、長距離輸送における中和作用、酵素活性についてカリウムの代替となることができるが。その性質の強さによって植物は次の4つのグループに分類される。 グループA ナトリウムが大部分のカリウムの代替となることができ、ナトリウムも施用するとカリウムだけの場合と比べて生長が促進される。 グループB ナトリウムに対して特異的な反応を示すが大きな効果はない。 グループC わずかな量のカリウムの代替しかできず、カリウムだけの場合と比べてナトリウムとの施用に効果は見られない。 グループD ナトリウムはカリウムの代替とならない。 ナトリウムは葉面積の増大や水分調節を促進する。
※この「ナトリウム」の解説は、「栄養素 (植物)」の解説の一部です。
「ナトリウム」を含む「栄養素 (植物)」の記事については、「栄養素 (植物)」の概要を参照ください。
ナトリウム
出典:『Wiktionary』 (2021/06/29 14:08 UTC 版)
名詞
ナトリウム
訳語
- アイスランド語: natrín (is) 中性, natríum (is) 中性
- アイルランド語: sóidiam (ga)
- アストゥリアス語: sodiu (ast) 男性
- アフリカーンス語: natrium (af)
- アラゴン語: sodio (an) 男性
- アラビア語: صُودْيُوم (ar) (ṣodyum) 男性
- アルバニア語: natrium (sq)
- アルメニア語: նատրիում (hy)
- イタリア語: sodio (it) 男性
- イド語: natro (io)
- インターリングア: sodium (ia), natrium (ia)
- インドネシア語: natrium (id)
- ウェールズ語: sodiwm (cy)
- ヴォラピュク: natrin (vo)
- ウクライナ語: на́трiй (uk) 男性
- ウズベク語: natriy (uz), натрий (uz) (natriy)
- 英語: sodium (en)
- エストニア語: naatrium (et)
- エスペラント: natrio (eo)
- オック語: sòdi (oc) 男性
- オランダ語: natrium (nl) 中性
- カザフ語: натрий (kk)
- カシューブ語: natrijô (csb)
- カタルーニャ語: sodi (ca) 男性
- ガリシア語: sodio (gl) 男性
- カンナダ語: ಸೋಡಿಯಮ್ (kn)
- ギリシア語: νάτριο (el) 中性
- クメール語: សូឌីយ៉ូម (km) (soodiiyoom)
- グルジア語: ნატრიუმი (ka)
- クルド語: natrîyûm (ku)
- ケチュア語: natriyu (qu)
- コーンウォール語: sodyum (kw)
- コルシカ語: sodiu (co)
- サンスクリット: विक्षार (sa) (vikshaar)
- シチリア語: sodiu (scn)
- ジャワ語: natrium (jv)
- スウェーデン語: natrium (sv) 中性
- スコットランド・ゲール語: sòidiam (gd)
- スペイン語: sodio (es) 男性
- スロヴァキア語: sodík (sk) 男性
- スロヴェニア語: natrij (sl)
- スワヒリ語: natiri (sw), sodiamu (sw)
- セルビア・クロアチア語:
- タイ語: โซเดียม (th) (sōdiam)
- タガログ語: sodyo (tl)
- タジク語: натрий (tg)
- タミル語: உவர்மம் (ta)
- チェコ語: sodík (cs) 男性
- 中国語: (繁): 鈉/ (簡): 钠 (nà)
- 朝鮮語: 나트륨 (ko), 소듐 (ko)
- 低地ドイツ語: natrium (nds)
- ディベヒ語: ސޯޑިއަމް (dv)
- テルグ語: సోడియమ్ (te)
- デンマーク語: natrium (da) 中性
- ドイツ語: Natrium (de) 中性
- パンジャブ語: ਸੋਡੀਅਮ (pa)
- トルコ語: sodyum (tr)
- ナヴァホ語: soodin (nv)
- 西フリジア語: natrium (fy) 中性
- ノヴィアル: natrium (nov)
- ノルウェー語: natrium (no)
- ノルマン語: sôdgium (nrf)
- ハイチ語: sodyòm (ht)
- バスク語: sodioa (eu)
- ハワイ語: sodiuma (haw)
- ハンガリー語: nátrium (hu)
- ヒンディー語: क्षारातु (hi) (kshaaraatu)
- フィンランド語: natrium (fi)
- フェロー語: natrium (fo) 中性
- フランス語: sodium (fr) 男性
- フリウリ語: sodi (fur)
- ブルガリア語: на́трий (bg) 男性
- ブルトン語: natriom (br) 男性, sodiom (br) 男性
- ベトナム語: natri (vi)
- ヘブライ語: נתרן (he) (natran)
- ベラルーシ語: на́трый (be) 男性
- ペルシア語: سدیم (fa)
- ベンガル語: লবণক (bn) (labanak)
- ポーランド語: sód (pl) 男性
- ポルトガル語: sódio (pt) 男性
- マオリ語: konutai (mi)
- マケドニア語: натриум (mk) 男性
- マラーティー語: सोडियम (mr) (sōḍiyam)
- マラヤーラム語: സോഡിയം (ml)
- マルタ語: sodju (mt)
- マレー語: natrium (ms)
- マン島語: sodjum (gv)
- モンゴル語: натри (mn)
- ラテン語: natrium (la)
- ラトヴィア語: nātrijs (lv)
- リトアニア語: natris (lt)
- リンガラ語: sodu (ln)
- ルーマニア語: sodiu (ro) 中性, natriu (ro) 中性
- ルクセンブルク語: Natrium (lb)
- ロシア語: на́трий (ru) 男性
- ロジバン: sodna (jbo)
- ワロン語: sodiom (wa)
「ナトリウム」の例文・使い方・用例・文例
- 炭酸水素ナトリウムは酸溶液を中和するだ。
- 硬せっけん, ナトリウムせっけん.
- 重炭酸ナトリウム, 重曹.
- 炭酸ナトリウム.
- 塩化ナトリウム, 食塩.
- シアン化[青酸]ナトリウム.
- 水酸化ナトリウム, 苛性(かせい)ソーダ.
- 硝酸ナトリウム.
- ナトリウムは反応金属である
- 脂肪とナトリウムで低い食物と心臓病を伸ばすかもしれない他の成分について
- バルビツール酸塩として使用されるアモバルビタールのナトリウム塩
- ナトリウム利尿の、または、ナトリウム利尿に関する
- オリーブオイルと水酸ナトリウムからできた良質の固い石鹸
- 水酸化ナトリウムで扱われる、それを縮めて、染料のためにその光沢と親近感を増加させた綿の糸について
- ニトログリセリンが木材パルプの基とナトリウムまたは硝酸カリウムにおいて吸収されるダイナマイトのタイプ
- ブドウ球菌のペニシリン耐性種に起因する感染症を治療するのに用いられる(通常そのナトリウム塩の形で)ペニシリンのペニシリナーゼ耐性形(商標名Nafcil)
- 鎮静用のナトリウムソルトとしてまた痙攣を治療するために用いられる白くて無臭のかすかに苦い粉末であるバルビツール酸塩(商標名セコナール)
- 電流がナトリウム蒸気のチューブを通り抜けたランプは黄色の光を生じる
- 塩分の摂取量(塩化ナトリウム)を制限する食事
- 炭酸ナトリウムと酒石英でわずかに膨らませた甘くないクラッカー
ナトリウムと同じ種類の言葉
- ナトリウムのページへのリンク