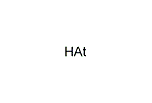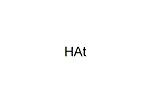アスタチン【astatine】
アスタチン
アスタチン
アスタチン
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/08/14 08:44 UTC 版)

|
この記事は英語版の対応するページを翻訳することにより充実させることができます。(2023年11月)
翻訳前に重要な指示を読むには右にある[表示]をクリックしてください。
|
|
||||||||||||||||||||||
| 外見 | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 黒色固体(推定) | ||||||||||||||||||||||
| 一般特性 | ||||||||||||||||||||||
| 名称, 記号, 番号 | アスタチン, At, 85 | |||||||||||||||||||||
| 分類 | ハロゲン | |||||||||||||||||||||
| 族, 周期, ブロック | 17, 6, p | |||||||||||||||||||||
| 原子量 | (210) | |||||||||||||||||||||
| 電子配置 | [Xe] 4f14 5d10 6s2 6p5 | |||||||||||||||||||||
| 電子殻 | 2, 8, 18, 32, 18, 7(画像) | |||||||||||||||||||||
| 物理特性 | ||||||||||||||||||||||
| 相 | 固体 | |||||||||||||||||||||
| 融点 | 575 K, 302 °C, 576 °F | |||||||||||||||||||||
| 沸点 | 610 K, 337 °C, 639 °F | |||||||||||||||||||||
| 蒸発熱 | 40 kJ/mol | |||||||||||||||||||||
| 蒸気圧 | ||||||||||||||||||||||
|
||||||||||||||||||||||
| 原子特性 | ||||||||||||||||||||||
| 酸化数 | 7, 5, 3, 1, -1 | |||||||||||||||||||||
| 電気陰性度 | 2.2(ポーリングの値) | |||||||||||||||||||||
| イオン化エネルギー | 1st: 890 ± 40 kJ/mol | |||||||||||||||||||||
| 共有結合半径 | 150 pm | |||||||||||||||||||||
| ファンデルワールス半径 | 202 pm | |||||||||||||||||||||
| その他 | ||||||||||||||||||||||
| 磁性 | no data | |||||||||||||||||||||
| 熱伝導率 | (300 K) 1.7 W/(m⋅K) | |||||||||||||||||||||
| CAS登録番号 | 7440-68-8 | |||||||||||||||||||||
| 主な同位体 | ||||||||||||||||||||||
| 詳細はアスタチンの同位体を参照 | ||||||||||||||||||||||
|
||||||||||||||||||||||
アスタチン(英: astatine [ˈæstətiːn, -tɨn])は、原子番号85の元素。元素記号は At。ハロゲン元素の一つ。約30の同位体が存在するが、安定同位体は存在せず半減期も短いため、詳しく分っていない部分が多い。
名称
半減期が短いため、ギリシア語で「不安定な」を意味するastatosが語源。
歴史
アスタチンはメンデレーエフによって「エカヨウ素」として予言された[1]。1932年、アラバマ工科大学のフレッド・アリソンがモナザイトから85番元素を発見したと発表し、アラバミン(Alabamine - 元素記号 Ab)と命名したが後に否定された。1940年、アメリカのカリフォルニア大学バークレー校でセグレが、ビスマス209にサイクロトロンで加速したアルファ粒子を照射することによりアスタチン211を初めて生成した[2][3]。
特徴
アスタチンは壊変系列中の短寿命生成物として存在する元素で半減期が短いのが特徴である。したがって、実験している最中にどんどん崩壊して他の元素に変わっていくため、その詳しい化学的、物理的性質は分かっていない部分が多い。融点は302 °C、沸点は337 °C(アスタチン210のものと思われる)である。
昇華性があり、水に溶け、ヨウ素に似た化学的性質を持つが、ビスマスやポロニウムのように金属と非金属の中間的性質を持つ。アスタチンはヨウ素のように甲状腺に蓄積すると思われている。また色は黒もしくは銀色と推測されている。
また、常温では揮発するが、水溶液は安定しており、四塩化炭素によって水溶液からの抽出も可能である。
自然界にはアスタチン215、アスタチン217、アスタチン218、アスタチン219の存在が知られており、それ以外の同位体は人工放射性同位体である。アスタチンの人工放射性同位体の中で最も普通に作られるのはアスタチン210、アスタチン211である。
用途
アスタチンは強い放射能と短い半減期(アスタチン210でも8.1時間しかない)のため、研究用以外に用途はない。
しかし、アスタチン211は高エネルギーのα線を放出するため細胞殺傷性があり、抗癌剤としての用途が期待されている。現在はアスタチン211の運び屋となる比較的長い半減期を持つ放射性同位体が研究されている。
同位体
アスタチンの同位体は、質量数191から223までの間に30種以上が確認されている。しかし前述のとおり安定同位体は存在せず半減期は一番短いアスタチン213で125ナノ秒、一番長いアスタチン210で8.1時間と短い。その他、20種以上の核異性体も確認されている。
アスタチン211
アスタチン211は7.2時間の半減期を持つ同位体である。生成法はいくつかある[4][5]が、大量生産には液体ビスマスをターゲットとする209
Bi + α → 211
At + 2n反応が必須とされ[6]、アミノ酸と結合させたアスタチン211製剤が甲状腺がんの放射線治療に使われる[7][8]。日本では、2022年内服療法の第1相臨床試験が開始された[9]。
自然界での発生
アスタチンは壊変系列中の短寿命生成物として存在するため、鉱物の主成分とはならず、自然界では非常に稀な元素である。そして、アスタチンはすべての元素の中で地殻含有量が最も少ない元素で、ウラン100万個の原子の中にはアスタチンの原子は数個しか存在しない。地殻中に存在するアスタチンの全量はおよそ1オンス (28 g)といわれている[注釈 1]。
アスタチン218(半減期1.6秒)はウラン系列中でポロニウム218のβ崩壊により生じる。また、アクチニウム系列中では、フランシウム223のα崩壊によりアスタチン219(半減期56秒)が、ポロニウム215のβ崩壊によりアスタチン215(半減期0.001秒)が生じ、ネプツニウム系列中では、フランシウム221からアスタチン217(半減期0.323秒)が生じる。
アスタチンの化合物
酸化数は7, 5, 3, 1, -1価をとることがわかっている。うち、他のハロゲン同様-1価が最も安定である。
他のハロゲンと同じように水素との化合物を作ることが知られている。知られている化合物の中では、-1価の化合物が最も多い。
- アスタチン化水素 (HAt)
- 性質はヨウ化水素に似ており、刺激臭を持つ有毒な気体と考えられている。
その他にも AtO、AtO3 などの化合物も確認されている。
脚注
注釈
出典
- ^ 桜井弘『元素111の新知識』講談社、1998年、347頁。ISBN 4-06-257192-7。
- ^ Corson, D. R.; MacKenzie, K. R.; Segrè, E. (1940-03-01). “Possible Production of Radioactive Isotopes of Element 85”. Physical Review 57 (5): 459–459. doi:10.1103/PhysRev.57.459.
- ^ Corson, D. R.; Mackenzie, K. R.; Segrè, E. (1947-01). “Astatine : The Element of Atomic Number 85” (英語). Nature 159 (4027): 24–24. doi:10.1038/159024b0. ISSN 1476-4687.
- ^ 豊嶋厚史 & 篠原厚 2018.
- ^ 羽場宏光「理研における核医学治療用ラジオアイソトープの製造」『Drug Delivery System』第35巻第2号、日本DDS学会、2020年、114-120頁、doi:10.2745/dds.35.114、 ISSN 0913-5006、 NAID 130007864106。
- ^ 石岡典子、渡辺茂樹、近藤浩夫、高井俊秀、古川智弘『がん治療用アスタチン211 の連続製造を可能にする液体ビスマス標的の開発 (pdf)』『日本原子力学会 2019年秋の大会』(議事録)。
- ^ 渡部直史、兼田加珠子、白神宜史、大江一弘、豊嶋厚史、篠原厚「アスタチンを用いた難治性甲状腺がんに対するアルファ線核医学治療」『アイソトープ・放射線研究発表会』第1巻、日本アイソトープ協会、2021年、67頁、doi:10.50955/happyokai.1.0_67、 NAID 130008085301。
- ^ 貝塚祐太、鈴木博元、上原知也「がんの標的α線治療を実現する211At標識アミノ酸誘導体の開発に向けた基礎的評価」『アイソトープ・放射線研究発表会』第1巻、日本アイソトープ協会、2021年、120頁、doi:10.50955/happyokai.1.0_120、 NAID 130008085209。
- ^ 注目高まるα線内用療法、アスタチンに期待 日経メディカル 2021/12/03
参考文献
- 豊嶋厚史、篠原厚「アスタチン(At)の核化学」『RADIOISOTOPES』第67巻第10号、日本アイソトープ協会、2018年、461-469頁、doi:10.3769/radioisotopes.67.461、 ISSN 0033-8303、 NAID 130007498107。
関連項目
外部リンク
アスタチン
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2022/06/05 10:03 UTC 版)
アスタチンは非金属もしくは半金属に分類される。通常は非金属として分類されるが、いくつかの著しい金属的な性質を有している。1940年、アスタチン原子の合成に直結した初期の研究者はアスタチンは金属であると考えていた。その後の1949年の言及では、アスタチンは還元するのが難しく最も不活性な非金属であり、同様に酸化するのが難しく比較的貴な金属であるとされていた。1950年には、アスタチンはハロゲンであるため活性な非金属であるとも言及された。 アスタチンの非金属的な性質としては以下のものがある。 バスタノフは0.7 eVというアスタチンのバンドギャップの計算値を与え、この値は非金属のものと一致している。伝導帯と価電子帯が切り離されているためアスタチンは絶縁体もしくは半導体である。 アスタチンは非金属のように液体状態である温度範囲が狭く、融点575 K、沸点610 Kであると推定されている。 アスタチンの水溶液中の化学的ふるまいは、様々な陰イオン種の形成に特徴づけられる。 アスタチンの既知の化合物としてアスタチン化物 (XAt)、アスタチン酸塩 (XAtO3)および1価のハロゲン間化合物があり、それらの性質はハロゲンであり非金属でもあるヨウ素の化合物に類似している。 アスタチンの金属的な性質としては以下のものがある。 サムソノフは典型的な金属のように、アスタチンは強酸酸性溶液から硫化水素にすらも沈殿させられ、硫酸溶液からはアスタチンが遊離する形で置換させられ、電気分解によって陰極上に堆積させられる。ということを観察した。 レスラーは、アスタチンの(重)金属的な傾向の更なる兆候について、擬ハロゲン化物、アスタチン陽イオンの錯体、3価のアスタチン陰イオンの錯体ならびに様々な有機溶媒との錯体の形成。を挙げた。 ラオおよびガングリーは、42 kJ/molよりも大きい蒸発熱を持つ元素は液体状態において金属的である点に着目した。そのような元素はホウ素、ケイ素、ゲルマニウム、アンチモン、セレンおよびテルルが含まれる。ヴァサロスおよびベレイは、2価のアスタチンの蒸発熱をこれらの元素の中で最も低い50 kJ/molであると見積もった。このことから、アスタチンは液体状態において金属的である。2価のヨウ素の蒸発熱は41.17 kJ/molであり、42 kJ/molという金属的な性質を示す閾値にわずかに足りていない。 チャンピオン他は、アスタチンは強酸酸性溶液中においてAt+およびAtO+として安定して存在し、陽イオンとしてのふるまいを示すとした。 Siekierskiとバージェスは、目に見えるほどの大きさに凝集したアスタチンはその激しい放射能による熱で直ちに完全に蒸発してしまうが、もし凝集相を形成することができるならばアスタチンは金属であるだろうと推定、主張した。
※この「アスタチン」の解説は、「半金属」の解説の一部です。
「アスタチン」を含む「半金属」の記事については、「半金属」の概要を参照ください。
アスタチン
出典:『Wiktionary』 (2021/08/28 14:22 UTC 版)
名詞
アスタチン
語源
発音(?)
- あ↗すた↘ちん
翻訳
- アイスランド語: astat (is)
- アイルランド語: astaitín (ga)
- アストゥリアス語: astatu (ast) 男性
- アフリカーンス語: astaat (af)
- アラビア語: أستاتين (ar) (ʾastatīn) 男性
- アルバニア語: astat (sq)
- アルメニア語: աստատ (hy)
- イタリア語: astato (it) 男性
- インドネシア語: astatin (id)
- ウェールズ語: astatin (cy)
- ヴォラピュク: lastatin (vo)
- ウクライナ語: аста́т (uk) 男性
- ウズベク語: astat (uz), astatin (uz)
- 英語: astatine (en)
- エストニア語: astaat (et)
- エスペラント: astato (eo)
- オランダ語: astatium (nl) 中性, astaat (nl) 中性
- カザフ語: астатин (kk)
- カシューブ語: astat (csb)
- カタルーニャ語: àstat (ca)
- ガリシア語: astato (gl)
- ギリシア語: άστατο (el) 中性
- グルジア語: ასტატი (ka)
- クロアチア語:
- コーンウォール語: astatyn (cor)
- スウェーデン語: astat (sv) 中性
- スコットランド・ゲール語: astaitain (gd)
- スペイン語: astato (es) 男性
- スロヴァキア語: astat (sk) 男性
- スロヴェニア語: astat (sl) 男性
- タイ語: แอสทาทีน (th) (àesthāthīn)
- タジク語: астат (tg)
- タミル語: அஸ்தாதைன் (ta)
- チェコ語: astat (cs) 男性
- 中国語:
- 朝鮮語: 아스타틴 (ko)
- デンマーク語: astat (da)
- ドイツ語: Astat (de) 中性, Astatin (de) 中性
- トルコ語: astat (tr), asatatin (tr)
- 西フリジア語: astaat (fy)
- ノルウェー語:astat (no)
- バスク語: astatoa (eu)
- ハンガリー語: asztácium (hu)
- ヒンディー語: लावणी (hi) (lāvanī)
- フィンランド語: astatiini (fi)
- フェロー語: astatan (fo) 中性
- フランス語: astate (fr) 男性
- フリウリ語: astat (fur)
- ブルガリア語: астати́н (bg) 男性
- ブルトン語: astat (br)
- ベトナム語: astatin (vi)
- ヘブライ語: אסטטין (he) (astatín)
- ベラルーシ語: аста́т (be) 男性
- ペルシア語: استاتین (fa) (astâtin)
- ポーランド語: astat (pl) 男性
- ポルトガル語: astato (pt) 男性
- マケドニア語: аста́т (mk) 男性
- マルタ語: astatin (mt)
- マレー語: astatin (ms)
- マン島語: astaçheen (gv)
- モンゴル語: астат (mn)
- ラテン語: astatium (la)
- ラトヴィア語: astats (lv) 男性
- リトアニア語: astatinas (lt) 男性
- ルーマニア語: astatin (ro) 中性
- ルクセンブルク語: Astat (lb)
- ロシア語: аста́т (ru) 男性, астати́н (ru) 男性
「アスタチン」の例文・使い方・用例・文例
- アスタチンのページへのリンク