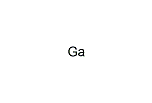ガリウム【gallium】
ガリウム
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/07/28 17:48 UTC 版)

|
|||||||||||||||||||
| 外見 | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
銀白色 |
|||||||||||||||||||
| 一般特性 | |||||||||||||||||||
| 名称, 記号, 番号 | ガリウム, Ga, 31 | ||||||||||||||||||
| 分類 | 貧金属 | ||||||||||||||||||
| 族, 周期, ブロック | 13, 4, p | ||||||||||||||||||
| 原子量 | 69.723(1) | ||||||||||||||||||
| 電子配置 | [Ar] 4s2 3d10 4p1 | ||||||||||||||||||
| 電子殻 | 2, 8, 18, 3(画像) | ||||||||||||||||||
| 物理特性 | |||||||||||||||||||
| 相 | 固体 | ||||||||||||||||||
| 密度(室温付近) | 5.91 g/cm3 | ||||||||||||||||||
| 融点での液体密度 | 6.095 g/cm3 | ||||||||||||||||||
| 融点 | 302.9146 K, 29.7646 °C, 85.5763 °F | ||||||||||||||||||
| 沸点 | 2676 K, 2403 °C, 4357 °F | ||||||||||||||||||
| 融解熱 | 5.59 kJ/mol | ||||||||||||||||||
| 蒸発熱 | 254 kJ/mol | ||||||||||||||||||
| 熱容量 | (25 °C) 25.86 J/(mol·K) | ||||||||||||||||||
| 蒸気圧 | |||||||||||||||||||
|
|||||||||||||||||||
| 原子特性 | |||||||||||||||||||
| 酸化数 | 3, 2, 1 (両性酸化物) |
||||||||||||||||||
| 電気陰性度 | 1.81(ポーリングの値) | ||||||||||||||||||
| イオン化エネルギー | 第1: 578.8 kJ/mol | ||||||||||||||||||
| 第2: 1979.3 kJ/mol | |||||||||||||||||||
| 第3: 2963 kJ/mol | |||||||||||||||||||
| 原子半径 | 135 pm | ||||||||||||||||||
| 共有結合半径 | 122 ± 3 pm | ||||||||||||||||||
| ファンデルワールス半径 | 187 pm | ||||||||||||||||||
| その他 | |||||||||||||||||||
| 結晶構造 | 斜方晶系 | ||||||||||||||||||
| 磁性 | 反磁性 | ||||||||||||||||||
| 電気抵抗率 | (20 °C) 270 nΩ⋅m | ||||||||||||||||||
| 熱伝導率 | (300 K) 40.6 W/(m⋅K) | ||||||||||||||||||
| 熱膨張率 | (25 °C) 1.2 μm/(m⋅K) | ||||||||||||||||||
| 音の伝わる速さ (微細ロッド) |
(20 °C) 2740 m/s | ||||||||||||||||||
| ヤング率 | 9.8 GPa | ||||||||||||||||||
| ポアソン比 | 0.47 | ||||||||||||||||||
| モース硬度 | 1.5 | ||||||||||||||||||
| ブリネル硬度 | 60 MPa | ||||||||||||||||||
| CAS登録番号 | 7440-55-3 | ||||||||||||||||||
| 主な同位体 | |||||||||||||||||||
| 詳細はガリウムの同位体を参照 | |||||||||||||||||||
|
|||||||||||||||||||
ガリウム (英: gallium [ˈɡæliəm]) は原子番号31の元素で、元素記号は Ga である。ホウ素、アルミニウムなどと同じ第13族元素に属する。
名称
命名には2つの説がある。一つは、ガリウムの発見者であるボアボードランがこの新しい元素を母国フランスのラテン名「ガリア (Gallia)」にちなんでガリウムと命名したとする説、もう一つはボアボードランのミドルネームである “Lecoq” から関連付けて、フランス語で雄鶏を意味する “le coq” のラテン語である gallus から付けられたとする説である。ただし、後者は1877年に本人によって否定されている[1]。
歴史

ドミトリ・メンデレーエフが1870年に周期表を発表した際、「エカ=アルミニウム (eka-alminium)」として予言した元素である。メンデレーエフはこの元素の原子量や比重などを予測した[2]。
1875年にポール・ボアボードランがピレネー山脈産の閃亜鉛鉱を分光法によって分析した際、特徴的な2本の紫色の光線として発見した[3]。また、同年ボアボードランは溶融させた水酸化カリウムに水酸化ガリウム(III) を加えて溶融塩電解することによって金属ガリウムを得ることに成功している。メンデレーエフの予測した密度の理論値5.9は、実測値である5.94と非常に一致しているなど、予測された多くの物性は非常に密接に実測値と一致していた[4]。この「エカ=アルミニウム」の予測物性と「ガリウム」の実測物性の近似は、当時評価を受けていなかったメンデレーエフの周期表が注目を浴びるきっかけとなった[5]。
性質
圧力、温度によっていくつかの安定な結晶構造がある。常温、常圧では斜方晶系が安定(比重 5.9)で、青みがかった金属光沢がある金属結晶である。融点は 29.8 °C と低いが、一方、沸点は 2403 °C[6][7](異なる実験値あり)と非常に高い。酸にもアルカリにも溶ける両性である。価電子は3個 (4s, 4p) だが、3d軌道も比較的浅いところにある。
また、水と同じように、液体の方が固体よりも体積が小さい異常液体である。ガリウムは固体から液体になると、その体積が約3.4%減少する。そのため金属のガリウムをガラス容器に保管すると相転移に伴う体積変化によって容器が破損するため、通常はポリ容器に保管される。
単体のガリウムは自然では産出しないが、溶解製錬によって簡単に得ることができる。高純度の金属ガリウムは光沢のある銀色であり、固体金属の断面はガラスに似た貝殻状断面となる。また、鉱酸によって徐々に溶解する。金属ガリウムは非常に柔らかく、モース硬度は1.5である[8]。液体から固体へと相転移する際に体積が3.2%増加する[9]。これは、固体状態において分子間結合を形成する物質の典型的な現象である[10]。そのため、金属やガラス容器での保管はガリウムの固化による容器破損を防ぐために避けられる。ガリウムのように液体の方が固体よりも高密度な材料は、ケイ素、ゲルマニウム、ビスマスおよび水のような限られたもののみである。
ガリウムは固体状態では反磁性であるが、液体状態では常磁性となり、40 °C における磁化率は χm = 2.4×10−6 である[11]。
ガリウムは、ほとんどの他の金属について金属格子に拡散して侵食する。例えば、ガリウムはアルミニウム-亜鉛合金[12]や鋼鉄[13]の粒界に侵食することで、それらを脆化させる。また、金属ガリウムは他の金属と容易に合金化し、その代表的なものとして磁歪材料や制振材料に用いられる鉄ガリウム合金 (FeGa) がある[14]。
融点は 302.9146 K (29.7646 °C) と室温に近く、人の手の上で融解する。ガリウムは過冷却となる傾向が非常に強いため、種結晶の添加による結晶化の促進を行わなければ融点以下の温度においても結晶化しにくい[15]。液体のガリウムは毒性は強くなく予防措置の必要性は少ないものの、水銀と違ってガラスや金属、あるいは皮膚に対する濡れ性が強いため、機械的に取扱いが難しい。
構造

ガリウムは他の金属のような単純な結晶構造の形では結晶化せず、常圧状態において異なる条件下で形成される四つの既知の多形であるα、β、γ、δ-ガリウムと、高圧状態において形成される Ga-II、Ga-III、Ga-IV が存在する。通常の状態下において安定した状態は単位格子に八つの原子を含む斜方晶系であるα-ガリウムが形成する。α-ガリウムは、最も近い原子同士の距離は 244 pm、六つの隣接する原子とはさらに 39 pm 離れている。このような対称性の低い不安定な構造であることは、ガリウムの融点の低さの原因となっていると考えられている[16]。最も近い隣接した原子間の結合は共有結合的な性質を持っており、そのため Ga2 二量体は結晶の基礎的要素として見られ、共有結合した二量体がそれぞれ金属結合している構造を取る。これも、ガリウムが同族元素であるアルミニウムやインジウムと比較して著しく融点が低いことの説明とされる。この二量体のガリウムは液体状態においても安定であり、気体状態においても二量体のガリウムを検出することができる[17]。
過冷却状態の液体ガリウムからの結晶化によって、他の結晶形のガリウムを得ることができる。−16.3 °C 以上において単斜晶系のβ-ガリウムが形成され、これはガリウム原子がジグザグに並列した構造を取る。−19.4 °C 以上では三方晶系のδ-ガリウムが形成され、これは12個のガリウム原子が歪んだ形で配列した、α-ホウ素と同様の結晶構造を取る。−35.6 °C では最終的にγ-ガリウムが形成され、これは7個のガリウム原子が環状に配列し、その中央に直鎖型に配列したガリウム原子が相互に接続するような斜方晶系を取る[17]。
室温、高圧の状態においても他の結晶形のガリウムを得ることができる。詳しくは下に記した表の中にある「生成方法」項目を参照されたい。
| 多形 | α-Ga[18] | β-Ga[19] | γ-Ga[20] | δ-Ga[21] | Ga-II[22] | Ga-III[22] | Ga-IV[23] |
|---|---|---|---|---|---|---|---|
| 構造 |  |
 |
 |
 |
 |
 |
 |
| 結晶系の名称 | 斜方晶系 | 単斜晶系 | 斜方晶系 | 三方晶系 | 立方晶系 | 正方晶系 | 立方晶系 |
| 配位数 | 1+6 | 8 (2+2+2+2) | 3, 6–9 | 6–10 | 8 | 4+8 | 12 |
| 空間群 | Cmca | C2/c | Cmcm | R3m | I43d | I4/mmm | Fm3m |
| 格子定数 | a = 452.0 pm b = 766.3 pm c = 452.6 pm |
a = 276.6 pm b = 805.3 pm c = 333.2 pm β = 92° |
a = 1060 pm b = 1356 pm c = 519 pm |
a = 907.8 pm c = 1702 pm |
a = 459.51 pm | a = 280.13 pm c = 445.2 pm |
a = 408 pm |
| 格子あたりの原子数 | 8 | 8 | 40 | 66 | 12 | 3 | 4 |
| 生成方法 | ? | ? | ? | ? | 30 kbar 以上の高圧条件下において、各々8個の原子と隣接した立方晶系の安定した Ga-II が得られる[17]。 | 140 kbar 以上の高圧条件下において、インジウムの構造に対応した正方晶系の Ga-III が得られる[23]。 | 1200 kbar 以上の高圧条件下において、面心立方格子の構造を取る Ga-IV が得られる[23]。 |
化合物と化学反応
ガリウムの化合物は通常+3の酸化数をとる。ガリウム(I) の化合物も合成されているが、不均化によって直ちにガリウム(III) となる傾向がみられる。ガリウム(II) の化合物は、実際はガリウム(I) とガリウム(III) の混合物である[7]。
水溶液中の反応
ガリウムを強酸に溶かすと Ga2(SO4)3 や Ga(NO3)3 のようなガリウム(III) 塩を生成する。ガリウム(III) 塩の水溶液は水和ガリウムイオン [Ga(H2O)6]3+ を含んでいる[24]。水酸化ガリウム(III) Ga(OH)3 はガリウム(III) の水溶液にアンモニアを加えることで得られ、それを 100 °C で乾燥させると水酸化酸化ガリウム(III) GaO(OH) に変化する[25]。
アルカリ金属の水酸化物溶液はガリウムを溶解してガリウム酸イオン Ga(OH)4− を形成する[7][24][26]。水酸化ガリウム(III) も両性化合物であり、アルカリに溶解してガリウム酸塩を作る[27]。初期の研究では八面体形の Ga(OH)63- の存在が示唆されたが[28]、後の研究ではこのイオン種を見いだすことはできなかった[26]。
カルコゲン化物
金属ガリウムは常温で酸化被膜を形成するため空気と水に対して不活性である。しかしより高い温度では空気中の酸素と反応して酸化ガリウム(III) Ga2O3 が生じる[7]。この酸化ガリウム(III)は半導体素子やガスセンサー等に用いられる。また、酸化ガリウム(III)を金属ガリウムとともに真空中で 500 °C から 700 °C で加熱すると、暗褐色の酸化ガリウム(I) Ga2O が得られる[29]。酸化ガリウム(I) は非常に強い還元剤として働き、硫酸を硫化水素にまで還元することができる[30]。酸化ガリウム(I) は 800 °C で不均化を起こし金属ガリウムと酸化ガリウム(III) になる[31]。
硫化ガリウム(III) Ga2S3 は金属ガリウムと硫化水素とを 900 °C で反応させることによって得られ[32]、3つの結晶形を取りうる[33]。金属ガリウムの代わりに水酸化ガリウム(III) Ga(OH)3 と747 °Cで反応させることによっても得られる[34]。
-

窒化ガリウムの単結晶 ガリウムを 1050 °C でアンモニアと反応させると青色発光ダイオードの素材として知られる窒化ガリウム GaN が得られる。リン、ヒ素、アンチモンとも反応して二元化合物を作り、それぞれリン化ガリウム GaP、ヒ化ガリウム GaAs、アンチモン化ガリウム GaSb を形成する。これらの化合物は硫化亜鉛と同じ閃亜鉛鉱型構造を取り、ヒ化ガリウムは半導体材料として重要であり、リン化ガリウムは発光ダイオードの材料として利用されるなど、重要な半導体特性を有する[38]。リン化ガリウム、ヒ化ガリウム、アンチモン化ガリウムはいずれも金属ガリウムとリン、ヒ素、アンチモンとの直接反応によって合成され[39]、これらは窒化ガリウムよりも高い電気伝導性を示す[40]。リン化ガリウムは酸化ガリウム(I) とリンとの反応によって低温で合成することもできる[41]。
ガリウムは三元窒化物を形成する[39]。
-

ガランの二量体。ピンクの球は Ga、白は H を表す アルミニウムと同様ガリウムも水素化物 GaH3 を形成する。水素化ガリウム(III)(ガラン)は無色の液体であり[47]、LiGaH4 と塩化ガリウム(III) を −30 °C で反応させることによって得られる[48]。
-

ガリウムを利用した青色発光ダイオード マイクロ波集積回路や赤色発光ダイオード、半導体レーザーなどに用いられるヒ化ガリウムのようなIII-V族半導体の主要な材料である。窒化ガリウムは中村修二が開発した青色発光ダイオードの材料である。世界市場のガリウムの95%は半導体に使われているが、合金や燃料電池などの新規用途の開発も続けられている。
302.91 K (29.76 °C)~2676 K (2403 °C) と広い温度範囲で液体であるため、液柱温度計に用いられる[55][6]。水銀と違って低温での蒸気圧が低いことも、温度計への利用に有利である。
融点が低いため、低融点合金にも使われる。ガリウム68.5%、インジウム21.5%およびスズ10%からなる合金はガリンスタンとよばれ、毒性が低く常温で液体(融点−19 °C)であることから液体鏡式望遠鏡の水銀の代替として研究されており、また合金に含まれるインジウムの高速中性子に対する反応断面積の高さを利用して核融合炉の冷却材としても研究されている[56]。また、プルトニウム-ガリウム合金はトリニティ実験で使われた核爆弾および長崎に投下されたファットマンの中心核に用いられ、プルトニウムの結晶構造を安定化させるのに用いられた[57]。
生体内での利用
ガリウム(III) イオンは生体内で鉄(III)イオンと同じように振る舞うため、鉄(III) イオンが操作する生体反応に相互に作用して局在化する。この性質を利用して、疾患推定の検査であるシンチグラムにガリウム塩が使われている。またガリウムの生物学的役割は知られていないが、代謝の促進を促すことが示された[58]。
娯楽
融点(302.9146 K (29.7646 °C) )が一般的に室温よりも高く、また手指の摩擦熱によって容易に融点まで温度を上げられることから、いわゆる“スプーン曲げ”や“スプーン切断”用のスプーンの製造材料に用いられることがある。
その他
1990年、国際度量衡局が定めた国際温度目盛 (ITS-90) の定義定点の一つとして、標準気圧 (101,325 Pa) におけるガリウムの融解点である302.9146 K (29.7646 °C) が用いられた[59][60][61]。
ガリウムは電子ニュートリノの検出にも利用される。ロシアのバクサンニュートリノ観測所で行われたSAGE実験では,50-57トンもの液体ガリウムを地中深くに格納し、原子核の中性子がニュートリノの反応で陽子になりガリウムがゲルマニウムに変換される量が計測された。この実験は太陽ニュートリノ問題の研究のために計画されたが、その解決後もモデルの予想よりも20%も少ない検出量しか得られない問題が「ガリウムアノマリー」と呼ばれ、ステライルニュートリノとの関連などの研究が続けられている[62][63]。
人間の手のひらに固体のガリウムを乗せると体温で融け、融けたガリウムを別の容器などに移すと次第に固体に戻るため、融点に関する教材としての使い道がある。ただし、液体のガリウムは濡れ性が強く、手やガラスに付くと取れにくいので、取り扱いには注意を要する。
産出
ガリウムは自然界では単体としては存在せず、元素またはその化合物を抽出する一次原料としての高品位のガリウム鉱物もまた存在しない。地球の地殻には約 16.9 ppm 含まれている。ガリウムは、ボーキサイトの微量成分として抽出され、閃亜鉛鉱からも少量抽出される[55]。石炭、ダイアスポア、ゲルマニウムに含まれるガリウムは無視できるほどの量である。石炭を燃焼した粉塵には、少量のガリウムが含まれる場合があるが、通常、重量にして1%以下である。ガリウムの含有量が比較的多い鉱石としてはナミビアのツメブで産するゲルマナイトが知られているが、それでも含有率はわずかに0.6%–0.7%程度である[15]。
生産

高純度のガリウム ガリウムはアルミニウムや亜鉛を製錬する際の副産物として得られる。これらの2つの方法以外は経済的ではない。アルミニウム製錬での副産物として得るのが主流である。ボーキサイトからバイヤー法でアルミナを生産する際に、ここで得られるガリウムを含んだバイヤー液(アルミン酸ソーダ溶液)から、Ga2O3(酸化ガリウム(III))を沈殿させた後で、水銀陰極を用いて電解還元し、ガリウムを得る方法などがある。ガリウム含有溶液には他の金属も含まれるため、それらと分離して精製する必要がある。半導体として使用する場合には、ゾーンメルト法でさらに純度を高めたり、チョクラルスキー法を使って、単結晶を得ることができる。通常、99.9999%の純度が達成され、商業的に広く利用されている。世界全体の生産量は、2006年のガリウムの生産量は234トンで、採掘からは100トン未満が得られ、残りは電子部品の製造工程でのスクラップなどからリサイクルされると推定される。世界全体のガリウム生産量の98%を中国が占める(2022年現在)[64]。一方、日本はガリウムの最大の需要国であり、例えば2006年の日本のガリウム需要は168トンであり、これは世界の需要の約72%を占めている。また、日本でのスクラップ回収から得られる量は90トン以上と、大きな比率を占めている[65]。
脚注
出典
- ^ Moskalyk, R. R.: Gallium: the backbone of the electronics industry. In: Minerals Engineering. 2003, 16, 10, S. 921–929, doi:10.1016/j.mineng.2003.08.003.
- ^ William H. Brock: Viewegs Geschichte der Chemie. Vieweg, Braunschweig 1997, ISBN 3-540-67033-5, S. 206–207.
- ^ de Boisbaudran, Lecoq, “Caractères chimiques et spectroscopiques d'un nouveau métal, le gallium, découvert dans une blende de la mine de Pierrefitte, vallée d'Argelès (Pyrénées)”, Comptes rendus 81: 493 2010年11月15日閲覧。
- ^ Mary Elvira Weeks: Discovery of the Elements. 3. Auflage, Kessinger Publishing, 2003, ISBN 978-0-7661-3872-8, S. 215–219.
- ^ アイザック・アシモフ『化学の歴史』玉虫文一、竹内敬人 訳(第1刷)、ちくま学芸文庫、2010年(原著1967年)、170-175頁。ISBN 978-4-480-09282-3。
- ^ a b 村上 2004, p. 124.
- ^ a b c d e f Mary Eagleson, ed. (1994), Concise encyclopedia chemistry, Walter de Gruyter, p. 438, ISBN 3110114518
- ^ Helmut Sitzmann: Gallium. In: Römpp Chemie Lexikon. Thieme Verlag, Stand Dezember 2006.
- ^ J. F. Greber: Gallium and Gallium Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. 7. Auflage, Wiley-VCH, Weinheim 2005, doi:10.1002/14356007.a12_163.
- ^ O. Züger, U. Dürig: Atomic structure of the α-Ga(001) surface investigated by scanning tunneling microscopy: Direct evidence for the existence of Ga2 molecules in solid gallium. In: Phys. Rev. B. 1992, 46, S. 7319–7321, doi:10.1103/PhysRevB.46.7319.
- ^ Weast, Robert C. (ed. in chief): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990. Seiten E-129 bis E-145. ISBN 0-8493-0470-9. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ^ W. L. Tsai, Y. Hwu, C. H. Chen, L. W. Chang, J. H. Je, H. M. Lin, G. Margaritondo (2003), “Grain boundary imaging, gallium diffusion and the fracture behavior of Al–Zn Alloy – An in situ study”, Nuclear Instruments and Methods in Physics Research Section B 199: 457, doi:10.1016/S0168-583X(02)01533-1
- ^ Vigilante, G. N., Trolano, E., Mossey, C. (June 1999), Liquid Metal Embrittlement of ASTM A723 Gun Steel by Indium and Gallium, Defense Technical Information Center 2009年7月7日閲覧。
- ^ 広温度範囲で使用できるマイクロ磁歪アクチュエータ, 東京大学 工学系研究科 精密工学専攻 先端メカトロニクス研究室 2011年6月6日閲覧。
- ^ a b 千谷 1959, p. 402.
- ^ Ulrich Müller: Anorganische Strukturchemie. 6. Auflage, Vieweg+Teubner Verlag, 2008, ISBN 978-3-8348-0626-0, S. 228.
- ^ a b c Holleman & Wiberg 2007, p. 1181.
- ^ B. D. Sharma, J. Donohue: A refinement of the crystal structure of gallium. In: Zeitschrift für Kristallographie. 1962, 117, S. 293–300.
- ^ L. Bosio, A. Defrain: Structure cristalline du gallium β. In: Acta Cryst. 1969, B25, S. 995, doi:10.1107/S0567740869003360.
- ^ L. Bosio, H. Curien, M. Dupont, A. Rimsky: Structure cristalline de Ga γ. In: Acta Cryst. 1972, B28, S. 1974–1975, doi:10.1107/S0567740872005357.
- ^ L. Bosio, H. Curien, M. Dupont, A. Rimsky: Structure cristalline de Ga δ. In: Acta Cryst. 1973, B29, S. 367–368, doi:10.1107/S0567740873002530.
- ^ a b Louis Bosio: Crystal structure of Ga(II) and Ga(III). In: J. Chem. Phys. 1978, 68, 3, S. 1221–1223, doi:10.1063/1.435841.
- ^ a b c Takemura Kenichi, Kobayashi Kazuaki, Arai Masao: High-pressure bct-fcc phase transition in Ga. In: Phys. Rev. B. 1998, 58, S. 2482–2486, doi:10.1103/PhysRevB.58.2482.
- ^ a b Holleman & Wiberg 2001, p. 1033.
- ^ Downs 1993, pp. 440–441.
- ^ a b Sipos, Pál; Megyes, Tünde; Berkesi, Ottó (2008), “The Structure of Gallium in Strongly Alkaline, Highly Concentrated Gallate Solutions—a Raman and 71Ga-NMR Spectroscopic Study”, Journal of Solution Chemistry 37 (10): 1411-1418, doi:10.1007/s10953-008-9314-y
- ^ Downs 1993, p. 141.
- ^ N. A. Hampson (1971), Harold Reginald Thirsk, ed., Electrochemistry—Volume 3: Specialist periodical report, Great Britain: Royal Society of Chemistry, p. 71, ISBN 0851860273
- ^ Downs 1993, p. 285.
- ^ Downs 1993, p. 207.
- ^ Greenwood 1962, pp. 94–95.
- ^ Downs 1993, p. 162.
- ^ a b Greenwood 1962, p. 104.
- ^ Otfried Madelung (2004), Semiconductors: data handbook (3rd ed.), Birkhäuser, pp. 276–277, ISBN 3540404880
- ^ Greenwood 1962, pp. 104–105.
- ^ Krausbauer, L.; Nitsche, R.; Wild, P. (1965), “Mercury gallium sulfide, HgGa2S4, a new phosphor”, Physica 31 (1): 113-121, doi:10.1016/0031-8914(65)90110-2
- ^ Greenwood 1962, p. 94.
- ^ Holleman & Wiberg 2001, p. 1034.
- ^ a b Greenwood 1962, p. 99.
- ^ a b Greenwood 1962, p. 101.
- ^ Michelle Davidson (2006), Inorganic Chemistry, Lotus Press, p. 90, ISBN 8189093398
- ^ Downs 1993, pp. 128–129.
- ^ Downs 1993, p. 133.
- ^ Downs 1993, pp. 136–137.
- ^ a b Holleman & Wiberg 2001, p. 1036.
- ^ Amit Arora (2005), Text Book Of Inorganic Chemistry, Discovery Publishing House, pp. 389–399, ISBN 818356013X
- ^ 千谷 1959, p. 403.
- ^ a b Holleman & Wiberg 2001, p. 1031.
- ^ Holleman & Wiberg 2001, p. 1008.
- ^ Anthony J. Downs; Colin R. Pulham (1994), A. G. Sykes, ed., Advances in Inorganic Chemistry, Volume 41, Academic Press, pp. 198–199, ISBN 0120236419
- ^ コットン & ウィルキンソン 1987, pp. 337–341.
- ^ T.J. Mountziaris, S. Kalyanasundarama and N.K. Inglea (1993), “A reaction-transport model of GaAs growth by metalorganic chemical vapor deposition using trimethyl-gallium and tertiary-butyl-arsine”, Journal of Crystal Growth 131 (3-4): 283-299, doi:10.1016/0022-0248(93)90178-Y
- ^ 徳永裕樹ほか (2006), 大量生産GaN用MOCVD装置の開発, 大陽日酸
- ^ コットン & ウィルキンソン 1987, p. 341.
- ^ a b コットン & ウィルキンソン 1987, p. 323.
- ^ Lee C. Cadwallader (2003) (preprint), Gallium Safety in the Laboratory 2010年11月15日閲覧。
- ^ Sublette,Cary (2001-09-09), “Section 6.2.2.1”, Nuclear Weapons FAQ 2010年11月16日閲覧。
- ^ Winter, Mark, Scholar Edition: gallium: Biological information, The University of Sheffield and WebElements Ltd, UK 2010年11月15日閲覧。
- ^ Preston–Thomas, H. (1990), “The International Temperature Scale of 1990 (ITS-90)”, Metrologia 27: 3–10, doi:10.1088/0026-1394/27/1/002 2010年11月15日閲覧。
- ^ ITS-90 documents at Bureau International de Poids et Mesures 2010年11月15日閲覧。
- ^ Magnum, B.W.; Furukawa, G.T. (August 1990), Guidelines for Realizing the International Temperature Scale of 1990 (ITS-90), National Institute of Standards and Technology, NIST TN 1265 2010年11月15日閲覧。
- ^ “Baksan scales new neutrino heights – CERN Courier” (2017年5月19日). 2025年1月14日閲覧。
- ^ “未知の素粒子の存在を示唆!元素「ガリウム」をめぐる異常と壮大な仮説” (2024年9月27日). 2025年1月14日閲覧。
- ^ NHK, 中国のレアメタル戦略 ガリウム・ゲルマニウム規制の狙いは? 2023年8月8日閲覧。
- ^ 石油天然ガス・金属鉱物資源機構, ストロンチウム及びガリウムの需要・供給・価格動向等 2008年12月21日閲覧。
参考文献
- 千谷利三『新版 無機化学(上巻)』産業図書、1959年。
- Greenwood, N. N. (1962). Emeléus, Harry Julius; Sharpe, Alan G.. eds. Advances in inorganic chemistry and radiochemistry, Volume 5. Academic Press. ISBN 0-12023-605-2
- F・A・コットン、G・ウィルキンソン『コットン ウィルキンソン 無機化学(上)』中原勝儼 訳(原書第四版)、培風館、1987年。 ISBN 4-56304-192-0。
- Downs, Anthony John (1993). Chemistry of aluminium, gallium, indium, and thallium. Springer. ISBN 0-75140-103-X
- Holleman, Arnold Frederick; Wiberg, Egon (2001). Holleman-Wiberg's Inorganic Chemistry. Academic Press. ISBN 0-12352-651-5
- 村上雅人『元素を知る事典: 先端材料への入門』海鳴社、2004年。 ISBN 978-4-8752-5220-7。
- Holleman, Arnold F.; Wiberg, Nils (January 2007) (ドイツ語). Lehrbuch der Anorganischen Chemie (German Edition) (102nd ed.). Walter de Gruyter. p. 1181. ISBN 978-3-11-017770-1
関連項目
外部リンク
-
-
ガリウム
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2021/07/21 04:57 UTC 版)
ガリンスタン - ガリウム・インジウム・スズからなる常温で液体の合金。体温計や放熱グリスに使用される。
※この「ガリウム」の解説は、「液体金属」の解説の一部です。
「ガリウム」を含む「液体金属」の記事については、「液体金属」の概要を参照ください。
ガリウム
出典:『Wiktionary』 (2021/08/28 14:19 UTC 版)
名詞
ガリウム
発音(?)
- が↗り↘うむ
関連語
翻訳
- アイスランド語: gallín (is)
- アイルランド語: gailliam (ga)
- アストゥリアス語: galiu (ast) 男性
- アフリカーンス語: gallium (af)
- アラビア語: جاليوم (ar) (gályum) 男性
- アルバニア語: galium (sq)
- アルメニア語: գալիում (hy) (galium)
- イタリア語: gallio (it) 男性
- インターリングア: gallium (ia)
- ウェールズ語: galiwm (cy)
- ヴォラピュク: galin (vo)
- ウクライナ語: галiй (uk) (hálij) 男性
- ウズベク語: галлий (uz) (galliy)
- 英語: gallium (en)
- エストニア語: gallium (et)
- エスペラント: galio (eo), galiumo (eo)
- オランダ語: gallium (nl) 中性
- カザフ語: галлий (kk) (gálliy)
- カシューブ語: gôl (csb)
- カタルーニャ語: gal·li (ca) 男性
- ガリシア語: galio (gl) 男性
- ギリシア語: γάλλιο (el) (gállio) 中性
- グルジア語: გალიუმი (ka) (galiumi)
- クロアチア語:
- コーンウォール語: galyum (cor)
- スウェーデン語: gallium (sv) 中性
- スコットランド・ゲール語: gailliam (gd)
- スペイン語: galio (es) 男性
- スロヴァキア語: gálium (sk)
- スロヴェニア語: galij (sl)
- タイ語: แกลเลียม (th) (kaenliam)
- タジク語: galli' (tg)
- タミル語: மென்தங்கம் (ta) (men-thangam)
- チェコ語: gallium (cs)
- 中国語:
- 朝鮮語: 갈륨 (ko) (gallyum)
- デンマーク語: gallium (da)
- ドイツ語: Gallium (de) 中性
- トルコ語: galyum (tr)
- 西フリジア語: gallium (fy)
- ノルウェー語:gallium (no)
- バスク語: galioa (eu)
- ハンガリー語: gallium (hu)
- ヒンディー語: द्रवातु (hi) (dravaatu)
- フィンランド語: gallium (fi)
- フェロー語: gallium (fo)
- フランス語: gallium (fr) 男性
- フリウリ語: gali (fur)
- ブルガリア語: галий (bg) (gálij) 男性
- ブルトン語: galliom (br)
- ベトナム語: gali (vi)
- ヘブライ語: גליום (he) (galium)
- ベラルーシ語: галiй (be) (gálij) 男性
- ポーランド語: gal (pl) 男性
- ポルトガル語: gálio (pt) 男性
- マケドニア語: галиум (mk) (gálium) 男性
- マルタ語: gallju (mt)
- マレー語: galium (ms)
- マン島語: gallium (gv)
- モンゴル語: галли (mn) (galli)
- ラトヴィア語: gallijs (lv)
- リトアニア語: galis (lt)
- ルーマニア語: galiu (ro) 中性
- ルクセンブルク語: Gallium (lb)
- ロシア語: галлий (ru) (gállij) 男性
「ガリウム」の例文・使い方・用例・文例
- ガリウムのページへのリンク