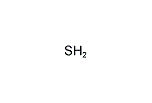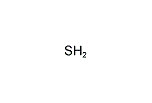硫化水素
硫化水素とは
硫化水素とは、硫黄と水素の無機化合物のこと。化学式がH2Sの気体で、腐った卵に似た臭いを持ち、空気に対する比重は1.1905とやや重たい。水に溶けやすく弱い酸性で、260度になると発火する。皮膚や粘膜を刺激する強い毒性があり、吸引すると意識が混濁して死亡することもある。硫化水素の発生源である硫黄と水素は多くの石油製品に含まれているので、誤った使用で中毒事故が起こるケースが少なくない。硫化水素の臭い
硫化水素は強い刺激臭を持つが嗅覚を麻痺させる作用もあるので、高濃度になると臭いを感じなくなる。気体は無色なので、実験など意図的に高濃度の硫化水素を発生させても気づかないことがある。硫化水素は毒性が高い
硫化水素は弱い酸性なのでアルカリ性の薬剤を用いることで中和させることが可能である。石油製品の製造現場や下水処理場など、硫黄と水素が結びつきやすい環境ではアルカリ性の中和剤を常備することで重大な事故を防ぐことができる。しかし、硫化水素の毒性は非常に高く、特有の臭いを感じないほどの高濃度な気体はわずかに吸引しても即座に昏倒して死亡するおそれがある。硫化水素が発生した場合には無理に中和させず、速やかにその場から離れることが望ましい。硫化水素は、空気より重たいので容器の内部やくぼんだ部分に溜まりやすい。硫化水素の発生現場では安易に体を屈めたり、容器の中に顔を近づけたりする行為は危険である。
りゅうか‐すいそ〔リウクワ‐〕【硫化水素】
硫化水素(H2S)
無色腐卵臭のある有毒な気体で水に溶けやすい。水溶液を硫化水素といい,弱酸性,空気中で酸化され硫黄を遊離する。青い炎をあげて燃え,二酸化硫黄と水になる。悪臭防止法による規制物質の一つ。
大気汚染防止法の特定物質(規制値なし,事故時の処置を定めている。)
硫化水素 Hydrogen Sulfide
硫化水素
硫化水素
硫化水素
硫化水素
硫化水素
硫化水素
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/09/24 05:59 UTC 版)

|
|||
|
|||
| 物質名 | |||
|---|---|---|---|
|
別名
|
|||
| 識別情報 | |||
|
3D model (JSmol)
|
|||
| バイルシュタイン | 3535004 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.029.070 | ||
| EC番号 |
|
||
| Gmelin参照 | 303 | ||
| KEGG | |||
| MeSH | Hydrogen+sulfide | ||
|
PubChem CID
|
|||
| RTECS number |
|
||
| UNII | |||
| 国連/北米番号 | 1053 | ||
|
CompTox Dashboard (EPA)
|
|||
|
|||
|
|||
| 特性 | |||
| 化学式 | H2S | ||
| モル質量 | 34.082 g/mol | ||
| 外観 | 無色気体 | ||
| 密度 | 1.363 × 10-3g/cm3, 1.1905(蒸気密度) | ||
| 融点 | -85.5 °C |
||
| 沸点 | -60.7 °C |
||
| 水への溶解度 | 0.25g /100 cm3 (40 °C) | ||
| 酸解離定数 pKa | 6.89 19 ± 2 |
||
| 0.97 D | |||
| 構造 | |||
| C2v | |||
| 折れ線 | |||
| 0.97 D | |||
| 熱化学 | |||
| 標準定圧モル比熱, Cp |
1.003 J K−1 g−1 | ||
| 標準モルエントロピー S |
206 J mol−1 K−1[2] | ||
| 標準生成熱 ΔfH |
−21 kJ mol−1[2] | ||
| 危険性 | |||
| GHSピクトグラム |    |
||
| GHSシグナルワード | 危険(DANGER) | ||
| Hフレーズ | H220, H330, H400 | ||
| Pフレーズ | P210, P260, P271, P273, P284, P304+P340, P310, P320, P377, P381, P391, P403, P403+P233, P405, P501 | ||
| 主な危険性 | 可燃性、高い毒性 | ||
| NFPA 704(ファイア・ダイアモンド) | |||
| 引火点 | −82.4 °C (−116.3 °F; 190.8 K) [4] | ||
| 発火点 | 232 °C (450 °F; 505 K) | ||
| 爆発限界 | 4.3–46% | ||
| 脱出限界濃度 | 100 ppm[5] | ||
| NIOSH(米国の健康曝露限度): | |||
| 勧告曝露限界 | C 10 ppm (15 mg/m3) [10-分][5] | ||
| 最低致死濃度 LCLo |
|
||
| 半数致死濃度 LC50 |
|
||
| 関連する物質 | |||
| 関連するカルコゲン化水素 | |||
| 関連物質 | ホスフィン | ||
|
特記無き場合、データは標準状態 (25 °C [77 °F], 100 kPa) におけるものである。
|
|||

硫化水素(りゅうかすいそ、英: hydrogen sulfide)は、化学式 H2S で表される硫黄と水素の無機化合物で、カルコゲン化水素の一つ。別名スルファン(sulfane)。無色の気体で、腐卵臭を持つ。空気に対する比重は1.1905である。
特徴
硫化水素は、空気より重く(比重1.1905)、無色、水によく溶け、弱い酸性を示す。
可燃性ガスであり、引火性がある。爆発限界は4.3 – 46 %。燃焼した場合には硫黄酸化物となる。
硫化水素は好気性生物の多くにとっては有毒であるが、酸素非発生型光合成、すなわち水素源として水ではなく硫化水素を用いる事で酸素の代わりに硫黄を放出する緑色硫黄細菌・紅色硫黄細菌などの光合成細菌も存在する一方、硫黄酸化細菌と称される化学合成細菌は硫化水素の酸化に伴い発生するエネルギーで炭酸同化を行う。後者は硫化水素の豊富な海底火山の熱水噴出孔付近で生産者の役割を担い、独自の生態系を形成している。
天然には火山中から火山ガスとして放出されるほか、温泉(硫化水素泉)中に含まれる[6][7]。人為的な発生源には石油化学工業などがあり、下水処理場、ごみ処理場などにおいても、硫黄が嫌気性細菌によって還元され硫化水素が発生する[8]。飲食店などの厨房排水で設置される分離槽や溜め枡内で、閉店後水が動かなくなると非常によく発生する。糞や屁にも若干含まれる。硫酸塩還元細菌による働きで、口臭にも含まれる[9]。
- 腐卵臭
- 硫化水素は、腐った卵の臭いの原因で[10]、その時の特徴的な強い刺激臭は「腐卵臭」と表現される。目、皮膚、粘膜を刺激する有毒な気体である。悪臭防止法に基づく特定悪臭物質のひとつ[11]。
- 噴火口から出る火山ガスや硫黄泉などの臭いが「硫黄の臭い」と形容される場合があるが、硫黄の単体(S)は無臭であり、これは硫化水素(H2S)の臭いをさしている[12]。空気よりも重いため火山地帯、温泉の吹き出し口などの窪地にたまりやすい[6][7][13]。
化学的性質
硫化水素は共有結合性の水素化合物で、硫黄と酸素とが周期表において同じ元素の族(第16族)であるため水と分子構造がよく似ている。密度は、空気を1とすると1.190であり空気よりも重い。
硫化水素
出典:『Wiktionary』 (2021/07/25 12:46 UTC 版)
名詞
発音(?)
- りゅ↗ーかす↘いそ
関連語
翻訳
- 英語: hydrogen sulfide (en), hydrogen sulphide (en) (英), rotten egg gas (en) (口語), swamp gas (en)
- オランダ語: waterstofsulfide (nl) 中性
- スウェーデン語: svavelväte (sv) 中性
- スペイン語: sulfuro de hidrógeno (es) 男性
- 中国語: 硫化氢 (cmn) (liúhuàqīng),繁体字:硫化氫
- 朝鮮語: 황화수소 (ko) (黃化水素, hwanghwasuso), 유화수소 (ko) (硫化水素, yuhwasuso)
- ドイツ語: Schwefelwasserstoff (de) 男性
- フィンランド語: rikkivety (fi), vetysulfidi (fi)
- フランス語: sulfure d'hydrogène (fr) 男性, hydrogène sulfuré (fr) 男性
- ポーランド語: siarkowodór (pl) 男性
- ルーマニア語: sulfură de hidrogen (ro)
- ロシア語: сероводород (ru) 男性, сульфид водорода (ru) 男性
「硫化水素」の例文・使い方・用例・文例
硫化水素と同じ種類の言葉
固有名詞の分類
- 硫化水素のページへのリンク