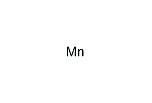満貫
マンガン【(ドイツ)Mangan】
読み方:まんがん
マンガン族元素の一。単体は銀白色の金属で、鉄より硬くてもろい。鉄に次いで広く分布し、主鉱石は軟マンガン鉱など。動植物体にも微量含まれ、発育・代謝に不可欠。合金添加剤や鋼の脱酸剤などに利用。元素記号Mn 原子番号25。原子量54.94。
まん‐がん〔‐グワン〕【万巻】
マンガン【満貫】
まん‐がん〔‐グワン〕【満願】
マンガン(Mn)
地殻中に存在する生物には必須元素の一種ですが,マンガンの製造,粉砕,マンガン塩類を製錬する時,マンガン鉱(褐石,MnO2)により中毒をおこすことがあり,慢性神経症(マンガン病)になる。マンガン塩による中毒については不明です。また,マンガンによる職業的中毒の例は比較的少ない。水道水質基準…0.3mg/L,排水基準(溶解性)…10mg/L以下
マンガン(Mn)
マンガン
マンガン
マンガン
マンガン
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2023/11/20 08:51 UTC 版)
|
||||||||||||||||||||||||||||||||||||||||
| 外見 | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
銀白色 |
||||||||||||||||||||||||||||||||||||||||
| 一般特性 | ||||||||||||||||||||||||||||||||||||||||
| 名称, 記号, 番号 | マンガン, Mn, 25 | |||||||||||||||||||||||||||||||||||||||
| 分類 | 遷移金属 | |||||||||||||||||||||||||||||||||||||||
| 族, 周期, ブロック | 7, 4, d | |||||||||||||||||||||||||||||||||||||||
| 原子量 | 54.938045(5) | |||||||||||||||||||||||||||||||||||||||
| 電子配置 | [Ar] 4s2 3d5 | |||||||||||||||||||||||||||||||||||||||
| 電子殻 | 2, 8, 13, 2(画像) | |||||||||||||||||||||||||||||||||||||||
| 物理特性 | ||||||||||||||||||||||||||||||||||||||||
| 相 | 固体 | |||||||||||||||||||||||||||||||||||||||
| 密度(室温付近) | 7.21 g/cm3 | |||||||||||||||||||||||||||||||||||||||
| 融点での液体密度 | 5.95 g/cm3 | |||||||||||||||||||||||||||||||||||||||
| 融点 | 1519 K, 1246 °C, 2275 °F | |||||||||||||||||||||||||||||||||||||||
| 沸点 | 2334 K, 2061 °C, 3742 °F | |||||||||||||||||||||||||||||||||||||||
| 融解熱 | 12.91 kJ/mol | |||||||||||||||||||||||||||||||||||||||
| 蒸発熱 | 221 kJ/mol | |||||||||||||||||||||||||||||||||||||||
| 熱容量 | (25 °C) 26.32 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||
| 蒸気圧 | ||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
| 原子特性 | ||||||||||||||||||||||||||||||||||||||||
| 酸化数 | 7, 6, 5, 4, 3, 2, 1, −1, −2, −3 (酸性酸化物、塩基性酸化物、両性酸化物) |
|||||||||||||||||||||||||||||||||||||||
| 電気陰性度 | 1.55(ポーリングの値) | |||||||||||||||||||||||||||||||||||||||
| イオン化エネルギー | 第1: 717.3 kJ/mol | |||||||||||||||||||||||||||||||||||||||
| 第2: 1509.0 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| 第3: 3248 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 127 pm | |||||||||||||||||||||||||||||||||||||||
| 共有結合半径 | 139±5(低スピン), 161±8(高スピン) pm | |||||||||||||||||||||||||||||||||||||||
| その他 | ||||||||||||||||||||||||||||||||||||||||
| 結晶構造 | 体心立方 | |||||||||||||||||||||||||||||||||||||||
| 磁性 | 常磁性 | |||||||||||||||||||||||||||||||||||||||
| 電気抵抗率 | (20 °C) 1.44 μΩ⋅m | |||||||||||||||||||||||||||||||||||||||
| 熱伝導率 | (300 K) 7.81 W/(m⋅K) | |||||||||||||||||||||||||||||||||||||||
| 熱膨張率 | (25 °C) 21.7 μm/(m⋅K) | |||||||||||||||||||||||||||||||||||||||
| 音の伝わる速さ (微細ロッド) |
(20 °C) 5150 m/s | |||||||||||||||||||||||||||||||||||||||
| ヤング率 | 198 GPa | |||||||||||||||||||||||||||||||||||||||
| 体積弾性率 | 120 GPa | |||||||||||||||||||||||||||||||||||||||
| モース硬度 | 6.0 | |||||||||||||||||||||||||||||||||||||||
| ブリネル硬度 | 196 MPa | |||||||||||||||||||||||||||||||||||||||
| CAS登録番号 | 7439-96-5 | |||||||||||||||||||||||||||||||||||||||
| 主な同位体 | ||||||||||||||||||||||||||||||||||||||||
| 詳細はマンガンの同位体を参照 | ||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
マンガン(満俺[1]、独: Mangan、英: manganese、羅: manganum)は原子番号25の元素。元素記号はMn。
名称
ギリシャのマグネシア地方で発見された Mágnes の石に由来する[2]ラテン語で「磁石」を意味するmagnesにちなむ[1]。
日本では満俺とも書く[1]。
性質
銀白色の金属で、比重は7.2(体心立方類似構造)、融点は1246 °C。マンガン族元素に属する遷移元素。温度によりいくつかの同素体が存在し、常温常圧で安定な構造は立方晶系である。これは硬く非常に脆い。空気中では酸化被膜を生じて内部が保護され、赤みがかった灰白色となる。酸(希酸)には易溶であり、淡桃色の2価のマンガンイオン Mn2+(aq) を生成する。
比較的反応性の高い金属で粉末状にすると空気中の酸素、水などとも反応する。化合物は2–7価までの原子価を取り得る(+2、+3、+4、+6、+7 が安定)。地球上には比較的豊富に存在するが、単体では産出しない。二酸化マンガンを触媒とする過酸化水素の水と酸素への分解反応は、日本の義務教育課程で触媒の実験の題材とされるため非常に有名である。
単体マンガン自体は常磁性であるが、合金にはホイスラー合金など強磁性を示すものがあり、さらに化合物にはさまざまな磁気的性質を示すものがある。ビスマスとの合金は強磁性体として知られるほか、フェライトに添加することでさまざまな特性を付加する。
歴史
スウェーデンのカール・ヴィルヘルム・シェーレ(C. W. Scheele)が1774年に発見、同年ヨハン・ゴットリーブ・ガーン(J. G. Gahn)が単体を単離した[3]。
用途
一番有名な用途は、二酸化マンガンがマンガン乾電池やアルカリ乾電池の正極に使われる。また、リチウム電池の正極にも用いられ、リチウムイオン二次電池の正極材料として研究されている。また、磁性材料として、マンガン、亜鉛、鉄を含む金属酸化物であるMnZnフェライトがインダクタやトランスのコア材料として用いられている。
マンガン単体が金属材料として用いられることはほとんどなく、合金として、マンガン鋼の原料や、フェロマンガンとして鋼材の脱酸素剤・脱硫黄剤などに使用される。鉄鋼用途で耐磨耗性、耐食性、靭性を付加するために、マンガン合金(フェロマンガン)や金属マンガンとしてマンガン分が添加される。
また、生物の必須元素としても知られており、硫酸マンガンなどの化合物は肥料としても用いられる。
産出
マンガンは単体としては産出せず、軟マンガン鉱(MnO2)、菱マンガン鉱(MnCO3)などとして産出する。
戦前では日本国内でも製鉄用に採掘され、第二次世界大戦中にはおもに乾電池用としてマンガンを採掘する鉱山が多数開発された。とくに後者は日本各地で見られ、京都府中部(丹波地方)を中心に近畿地方に零細鉱山が集中して存在していた。しかし、1950年代以降の鉱物資源の輸入自由化によって激しい競争に晒され、すべての鉱山が1970年代までに閉山に追い込まれた。前者は東日本に多く(北海道上国鉱山、同大江鉱山など)、規模が比較的大きいことから1980年代まで存続したが、現在では岩手県の野田玉川鉱山において宝飾品材料としてバラ輝石が限定的・間欠的に採掘されているほかは皆無である。
この金属は、日本国内において産業上重要性が高いものの、産出地に偏りがあり供給構造が脆弱である。日本では国内で消費する鉱物資源の多くを他国からの輸入で支えている実情から、万一の国際情勢の急変に対する安全保障策として国内消費量の最低60日分を国家備蓄すると定められている。
深海底には、マンガン、鉄などの金属水酸化物の塊であるマンガン団塊(マンガンノジュール)として存在しているが、コストの関係で試験的な採取に留まっている。
国別の産出量
2011年における国別の産出量は以下の通りである[4]。
| 順位 | 国 | マンガン鉱 の産出量 (万トン) |
全世界での割合(%) |
|---|---|---|---|
| 1 | 南アフリカ共和国 | 340 | 21.3 |
| 2 | オーストラリア | 320 | 20.0 |
| 3 | 中華人民共和国 | 280 | 17.5 |
| 4 | ガボン | 185.8 | 11.6 |
| 5 | ブラジル | 120.9 | 7.6 |
結晶構造
マンガンは温度により4つの相を持つ[5]。
- αマンガン
- 742 °C以下で安定。単位胞あたり58個の原子を含む複雑な立方晶(体心立方格子類似構造)。原子の位置により4種類の異なるスピンを持ち、全体としては磁気モーメントを持たない、広義の反強磁性体であると考えられている(詳細はいまだ明らかになっていない)。
- βマンガン
- 742–1095 °Cで安定。単位胞あたり20個の原子を含む複雑な立方晶。常磁性体である。
- γマンガン
- 1095–1134 °Cで安定。面心立方構造。反強磁性体である。
- δマンガン
- 1134–1245 °C(融点)で安定。体心立方構造。常磁性体である。
おもな化合物
- 過マンガン酸カリウム(KMnO4) - 酸化剤
- 二酸化マンガン(MnO2) - 触媒
同位体
人体への影響
摂取基準
| 属性 | 目安量(AI) (mg/日) |
耐容上限量(UL) (mg/日) |
|---|---|---|
| 男性(18歳以上) | 4.0 | 11 |
| 女性(18歳以上) | 3.5 |
| 属性 | 目安量(AI) (mg/日) |
耐容上限量(UL) (mg/日) |
NOAEL mg/日 |
|---|---|---|---|
| 男性(19歳以上) | 2.3 | 11 | |
| 女性(19歳以上) | 1.8 | ||
| 女性(妊娠) | 2.0 | ||
| 女性(授乳) | 2.6 | ||
生理作用
人体にとっての必須元素。骨の形成や代謝に関係し、消化などを助ける働きもある。一部では活性酸素対策としての必須ミネラルに挙げるものもいる。
不足すると成長異常、平衡感覚異常、疲れやすくなる、糖尿病(インスリンの合成能力が低下するため)、骨の異常(脆くなるなど)、傷が治りにくくなる、生殖能力の低下や生殖腺機能障害などが起こる。しかしマンガンは川など天然の水などに含まれ、上水道水としては多すぎてむしろ除去する場合があるなど、普通に生活していてマンガンが不足することはまずない。
中毒
マンガン鉱石精錬所作業員・れんが職人・鋼管製造業者など、過剰に曝露されるとマンガン中毒を起こす。
頭痛・関節痛・易刺激性・眠気などを起こし、やがて情動不安定・錯乱に至る。大脳基底核や錐体路も障害し、パーキンソン症候群・ジストニア・平衡覚障害を引き起こすほか、無関心・抑うつなどの精神症状も報告されている。マンガン曝露から離れれば、3–4か月で症状は消える。
酸素欠乏
マンガンは脱酸素剤として使用されるように強い酸素吸着作用があるため、十分に酸化されていない天然マンガンが多い地層の洞窟や井戸などでは、貧酸素化した地下水を経由して内部の空気の酸素が欠乏し、そこへ十分な換気を行わず奥へ入った場合は酸素欠乏症になり最悪の場合死亡するおそれがある。また肥料の撒きすぎによる土壌の酸化などで土中のマンガンが還元されたり、湖などの水底に溜まったマンガンが貧酸素水などで還元され、結果としてマンガンが酸欠状態を保持したり流れに乗って移動させてしまう現象などもある。
出典
- ^ a b c 新村出編『広辞苑 第六版』岩波書店、2008年、2672頁。
- ^ 寄与者:池田黎太郎, 市毛みゆき, 杉田克生, 『元素名語源集』 2014年, 千葉大学教育学部養護教育講座, doi:10.20776/B9784903328164, ISBN 9784903328164
- ^ 桜井弘『元素111の新知識』講談社、1998年、139~140頁。 ISBN 4-06-257192-7。
- ^ 『地理 統計要覧 2014年版』二宮書店、2014年、96頁。 ISBN 978-4-8176-0382-1。
- ^ 太田, 恵造『磁気工学の基礎 I』共立出版、1973年。 ISBN 4-320-00200-8。
- ^ 日本人の食事摂取基準(2015年版)
- ^ Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc.. Institute of Medicine (US) Panel on Micronutrients.Washington (DC): National Academies Press (US). (2001)
関連項目
外部リンク
- Manganese マンガン(英語) - (オレゴン州大学・ライナス・ポーリング研究所)
- マンガン - 素材情報データベース<有効性情報>(国立健康・栄養研究所)
- マンガン解説 - 同
- 『マンガン』 - コトバンク
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
|||||||||||||||||||||||||||||||||
マンガン
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2017/02/17 04:20 UTC 版)
マンガン(VII, IV, III)イオンを含む溶液は、水素化ホウ素ナトリウム溶液によってMn(II)へ還元されるとき化学発光(690nm)を示す。
※この「マンガン」の解説は、「化学発光」の解説の一部です。
「マンガン」を含む「化学発光」の記事については、「化学発光」の概要を参照ください。
マンガン
出典:『Wiktionary』 (2021/08/06 13:48 UTC 版)
語源
オランダ語 mangaanより。すでに宇田川榕菴の舎密開宗で使われている。[1]
名詞
マンガン
発音(?)
- ま↘んがん
翻訳
- アイスランド語: mangan (is) 中性
- アイルランド語: mangainéis (ga) 女性
- アストゥリアス語: manganesu (ast) 男性
- アフリカーンス語: mangaan (af)
- アラビア語: منجنيز (ar) (manganīz) 男性
- アルバニア語: mangan (sq) 男性
- アルメニア語: մանգան (hy)
- イタリア語: manganese (it) 男性
- イディッシュ語: מאַנגאַנעז (yi) 男性, מאַנגאַן (yi) 男性
- インターリングア: manganese (ia)
- ウェールズ語: manganîs (cy)
- ヴォラピュク: manganin (vo)
- ウクライナ語: марганець (uk) 男性
- ウズベク語: marganets (uz), марганец (uz)
- 英語: manganese (en)
- エストニア語: mangaan (et)
- エスペラント: mangano (eo)
- オランダ語: mangaan (nl) 中性, manganium (nl) 中性
- カザフ語: марганец (kk)
- カシューブ語: mangan (csb)
- カタルーニャ語: manganès (ca) 男性
- ガリシア語: manganeso (gl) 男性
- ギリシア語: μαγγάνιο (el) 中性
- グルジア語: მარგანეცი (ka)
- コーンウォール語: manganus (kw)
- スウェーデン語: mangan (sv) 中性
- スコットランド・ゲール語: mangaineis (gd)
- スペイン語: manganeso (es) 男性
- スロヴァキア語: mangán (sk) 男性
- スロヴェニア語: mangan (sl) 男性
- セルビア・クロアチア語:
- タイ語: แมงกานีส (th) (maengkānīt)
- タガログ語: mangganeso (tl)
- タジク語: манган (tg)
- タミル語: செவ்விரும்பு (ta)
- チェコ語: mangan (cs) 男性
- 中国語: (繁): 錳/ (簡): 锰 (měng)
- 朝鮮語: 망간 (ko) (manggan), 망가니즈 (ko)
- デンマーク語: mangan (da) 中性
- ドイツ語: Mangan (de) 中性
- トルコ語: mangan (tr)
- 西フリジア語: mangaan (fy)
- ノルウェー語: mangan (no) 中性
- バスク語: manganesoa (eu)
- ハンガリー語: mangán (hu)
- ヒンディー語: अयस (hi) (ayas)
- フィンランド語: mangaani (fi)
- フェロー語: mangan (fo) 中性
- フランス語: manganèse (fr) 男性
- フリウリ語: manganês (fur) 男性
- ブルガリア語: манган (bg) 男性
- ブルトン語: manganez (br) 男性
- ベトナム語: mangan (vi)
- ヘブライ語: מנגן (he) (mangán)
- ベラルーシ語: марганец (be) 男性
- ペルシア語: منگنز (fa) (mangènèz)
- ポーランド語: mangan (pl) 男性
- ポルトガル語: manganês (pt) 男性 (ブラジル), manganésio (pt) 男性 (ポルトガル)
- マケドニア語: манган (mk) 男性
- マルタ語: manganiż (mt)
- マレー語: mangan (ms), batu kawi (ms)
- マン島語: manganais (gv)
- モンゴル語: манган (mn)
- ラテン語: manganum (la) 中性
- ラトヴィア語: mangāns (lv)
- リトアニア語: manganas (lt)
- ルーマニア語: mangan (ro) 中性
- ルクセンブルク語: Mangan (lb)
- ロシア語: марганец (ru) 男性
参照
「マンガン」の例文・使い方・用例・文例
- 過マンガン酸カリウム.
- マンガン酸
- 溶液およびマンガン酸塩にのみ存在する二塩基酸(H2MnO4)
- 化学的にマンガンに類似し、いくつかの合金で使用される珍しい重い多価金属元素
- マンガン四酸化物から成る鉱物
- ハウスマン鉱として自然に見つけられたマンガンの酸化物
- 基礎的な酸化マンガンから成る黒い鉱物
- マンガンとバリウムの水和された塩基性酸化物から成る鉱物
- 二酸化マンガンから成る鉱物
- マンガン炭酸塩から成る鉱物
- 結晶性のケイ酸マンガンから成るピンク、または赤の鉱物
- ニッケル、銅および他の金属(鉄、マンガン、アルミニウムなど)の合金
- 大気温度でオーステナイトを保有するだけのニッケル、クロミウムまたはマンガンを含む鋼鉄
- 強度を上げるため、1−4パーセントのマンガンを含んだ真鍮
- 鋼鉄で、マンガン含有量が比較的多い(10−14%)もの
- アニオンとしてマンガンを含むマンガン酸の塩
- 過マンガン酸の濃い紫色の塩
- 溶液、または過マンガン酸塩の塩の溶液においてのみ知られている不安定な紫色の酸(HMnO4)
- マンガンを含んでいる銑鉄
- 鉄とマンガンの酸化タンタルからなる鉱物で、コロンバイトとともに、または、粗い花崗岩の中で生じる
マンガンと同じ種類の言葉
- マンガンのページへのリンク