たんぱく‐しつ【×蛋白質】
タンパク質
英訳・(英)同義/類義語:protein, Cerberus protein Cerberus
細胞を構成する主要成分で、アミノ酸がペプチド結合で重合し高分子化したもの。生物体の構造の維持や酵素としての機能を持つ。
| 酵素タンパク質モチーフなど: | タンパクキナーゼ タンパクファミリー タンパク複合体 タンパク質 タンパク質分解酵素 タンパク選別シグナル ターミナルデオキシリボヌクレオチジルトランスフェラーゼ |
タンパク質
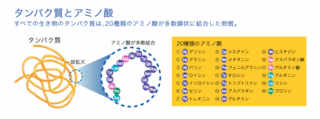
例えば、人間であれば筋肉や内臓などの構成成分であり、皮膚の色やお酒に強いか弱いかなどの性質を決めているのもタンパク質である。さらにホルモン、酵素、コラーゲン、ケラチンなど生物活動を担うタンパク質は10万種類以上もある。このように個々の組織や機能ごとに共通して必要なタンパク質もあれば、異なった種類のタンパク質もある。これは、タンパク質の種類によって働き方が違うからである。
ところでタンパク質はアミノ酸という物質が長く鎖のようにつながったものであるが、このアミノ酸の並び方でタンパク質の種類が違ってくる。そのため、生命活動の必要性に応じて、どのようなタンパク質を作ればよいのかは、細胞の中にあるこのアミノ酸の並び方を決めている遺伝子が命令を出している。
生物の体を構成している主な成分であり、細胞の主成分でもある。また、生きていく上で非常に重要な機能を果たすのがタンパク質である。
例えば、人間であれば筋肉や内臓などの構成成分であり、皮膚の色やお酒に強いか弱いかなどの性質を決めているのもタンパク質である。さらにホルモン、酵素、コラーゲン、ケラチンなど生物活動を担うタンパク質は10万種類以上もある。このように個々の組織や機能ごとに共通して必要なタンパク質もあれば、異なった種類のタンパク質もある。これは、タンパク質の種類によって働き方が違うからである。 ところでタンパク質はアミノ酸という物質が長く鎖のようにつながったものであるが、このアミノ酸の並び方でタンパク質の種類が違ってくる。そのため、生命活動の必要性に応じて、どのようなタンパク質を作ればよいのかは、細胞の中にあるこのアミノ酸の並び方を決めている遺伝子が命令を出している。 |
 拡大表示 |
タンパク質 [Protein(s)]
アミノ酸のみから構成されている場合を単純タンパク質、アミノ酸以外の成分も含まれて構成されている場合を複合タンパク質という。前者にはカゼイン、コラーゲン、ケラチン、アルブミン、プロタミン、ヒストンなどがあり、後者には糖タンパク質、リポタンパク質、核タンパク質、色素タンパク質、金属タンパク質、リンタンパク質などがある。すべての酵素もこれらのいずれかのタンパク質である。また、その分子の形状から繊維状タンパク質(ケラチン、コラーゲン)と多くの球状タンパク質に分けられる。
タンパク質の構造は順次、一次構造(アミノ酸の配列)、二次構造(α-ヘリックスやβ-構造、ランダムコイル)、三次構造(特定の空間的配置)をとり、さらに三次構造の単位(サブユニット)が集合して四次構造をつくっている。一般にタンパク質は熱で変性しやすいが、これはその高次構造が破壊されるからである(好熱菌のタンパク質は耐熱性)。一般にタンパク質を抗原として異種の動物へ接種するとそれの抗体ができる。その抗体は抗原タンパク質と抗原-抗体反応をおこすので、この反応を利用して微量のタンパク質を検出することができる。タンパク質の標準物質としてウシ血清アルブミン(分子量66,000)がよく用いられる。
タンパク質
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/07/19 06:01 UTC 版)

タンパク質(タンパクしつ、蛋白質、英: protein [ˈproʊtiːn]、独: Protein [proteˈiːn/protain])とはアミノ酸が鎖状に多数連結(重合)してできた高分子化合物。生物の重要な構成成分のひとつである[1]。
構成するアミノ酸の数や種類、また結合の順序によって種類が異なり、分子量約4000前後のものから、数千万から数億単位になるウイルスタンパク質まで多くの種類が存在する[1]。
タンパク質のうち、連結したアミノ酸の個数が少ないものをペプチド、ペプチドが直線状に連なったものをポリペプチドと呼びわける[2]ことも多いが、明確な基準は無い。
タンパク質は、炭水化物、脂質とともに三大栄養素と呼ばれ[3]、各々の英単語の頭文字を取って「PFC」とも呼ばれる。タンパク質は筋肉や骨、皮膚などをつくる役割も果たしている[3]。
名称
ドイツ語: Protein、英語: protein、フランス語: protéine [prɔtein]、スペイン語: proteína はギリシア語で「第一の」を意味する prōteîos から採られた。1838年にオランダの化学者ヨハンネス・ムルデルが、スウェーデンの化学者イェンス・ベルセリウスから助言を受け、窒素を非常に多く含む生物の基本要素と考えてこの名称をつけた[4]。
「蛋白質」の「蛋」とは卵のことを指し、卵白(蛋白)がタンパク質を主成分とすることによる。これは Protein がドイツ語でまた Eiweiß(卵白)とも訳され、これが日本語に直訳されたと考えられる[4]。
「蛋」という漢字は、例えば皮蛋のように中国ではよく使われる字であるが、日本ではあまり普及していない。そのため栄養学者の川島四郎が「蛋白質」では分かりにくいとして「卵白質」という語を使用したが、一般的に利用されるにはいたらなかった。 現在では、栄養学分野では平仮名の「たんぱく質」、生物学では片仮名の「タンパク質」が使われる傾向にある[5]。
構造
タンパク質は以下のような階層構造をもつ。
また、アミノ酸のみで構成された種類は単純タンパク質と言い、構成成分にアミノ酸以外のものが含まれる場合は複合タンパク質と呼ばれる[1]。
アミノ酸
食物として摂取したタンパク質は消化の過程でアミノ酸にまで分解され吸収され、体内で再びタンパク質へ構成される。このタンパク質を作る基本物質であるアミノ酸は、炭素元素を中心に水溶液中でプラスに荷電するアミノ基とマイナスに荷電するカルボキシ基を持ち、残り2箇所に水素と側鎖と呼ばれる分子構造を持つ[2]。タンパク質をつくるアミノ酸は20種類あるが、これらの差は側鎖の形状の違いで分けられる[2]。
一次構造
タンパク質はアミノ酸のポリマーである。その基本的な構造は2つのアミノ酸の一方のカルボキシ基 (−COOH) と他方のアミノ基 (−NH2) が水分子を1つ放出する脱水縮合(ペプチド結合)を起こして酸アミド結合 (−CO−NH−) を形成することでできる鎖状である[2]。また、システイン残基がしばしばジスルフィド結合 (S−S) の架橋構造をつくることもある。このポリマーの末端の結合していない部分は、アミノ基側をN末端、カルボキシ基側をC末端とよぶ[6]。この時、一列のアミノ酸の脇には側鎖が並ぶ事になり、この配列の数や順序を指してタンパク質の一次構造とよぶ[2]。
アミノ酸の配列は、遺伝子の本体である物質・DNAの塩基配列により決定される[6](3個のヌクレオチドにより、1つのアミノ酸が指定される)。ペプチド結合してタンパク質の構成成分となった単位アミノ酸部分 (−NH−CH(−R)−CO−) をアミノ酸残基と呼ぶ。それぞれの残基は、側鎖置換基 R の違いによって異なる性質をもつ。
二次構造
鎖状のポリペプチドは、それだけではタンパク質の機能を持たない。一次構造で並んだ側鎖が相互作用で結びつき、ポリペプチドには決まった2種類の方法で結びついた箇所が生じる。1つはαヘリックス(螺旋構造)と呼ばれ、あるアミノ酸残基の酸素と、4つ離れた残基の水素の結びつきを基礎に、同じ事が順次起こってポリペプチドにらせん構造をつくる[7]。もう1つのβシートとは、ポリペプチドの一部が折り畳まれ、それぞれの水素と酸素残基が結合してつくるシート状の構造である[7]。これらは二次構造と呼ばれる[8]。水素結合やファンデルワールス力などによるこの畳み込みはフォールディング (folding) とも呼ばれる[9]。結合エネルギーが比較的低いため、簡単な処理によって構造を変性させやすい[8]。
三次構造

タンパク質はαヘリックスやβシートといった二次構造の特定の組み合わせが局部的に集合し形成されたαヘアピンやβヘアピンなどの超二次構造と呼ばれる単位ができて核に纏まったドメインをとり、タンパク質全体としての三次構造をとる[10]。これは立体的に見てまとまった領域である。三次構造は側鎖間の相互作用によって安定する。特殊な塩基間の水素結合やシステイン残基間のジスルフィド結合、静電引力などが安定化に寄与するが、特に疎水結合が大きく影響する。そのため有機溶媒や界面活性剤などで疎水結合を切ると三次構造が壊れ、タンパク質の変性が起こりやすい[10]。三次構造の立体を図案化し描かれたものは「リボンモデル」と言う[7]。
四次構造

タンパク質の中には複数(場合によっては複数種)のポリペプチド鎖が非共有結合でまとまって複合体(会合体)を形成しているものがあり、このような関係を四次構造と呼ぶ[11]。各ポリペプチド鎖はモノマーまたはサブユニットと呼ばれ、複合体はオリゴマーと言う[11]。各サブユニットには疎水結合や水素結合またはイオン結合が広い領域に多数存在し相補的に働くために方向性があるため、サブユニットは全体で特定の空間配置(コンホメーション)を取る[11]。例えば、ヒトの赤血球に含まれ酸素を運ぶヘモグロビンは、α・β2種類のグロビンというサブユニットがそれぞれ2つずつ結びつく四次構造を持ったタンパク質の一種である[7]。
一次構造と高次構造の関係
タンパク質の立体構造は、そのアミノ酸配列(一次構造)により決定されていると考えられている(Anfinsenのドグマ)。また、二次以上の高次構造は、いずれも一次構造で決定されるアミノ酸配列を反映している。例えば Glu、Ala、Leu が連続するとαヘリックス構造をとりやすい。Ile、Val、Metはβシート構造をとりやすい。また各構造の継ぎ目の鋭角なターンの部分には Gly、Pro、Asn が置かれる、などの例がある。さらに、疎水性アミノ酸残基同士は引き合い(疎水結合)、Cys 同士はジスルフィド結合を形成して高次構造を安定化させる。
プロテオーム
生体のタンパク質を構成するアミノ酸は20種類あるが[1]、それが3つ連結したペプチドだけでも約203=8000通りの組み合わせがあり得る。タンパク質については、その種類は数千万種と言われる。生物の遺伝子(ゲノム)から作られるタンパク質ひとそろいのセットは、プロテオームと呼ばれるが、ヒトゲノムの塩基配列解読が終わった今、プロテオームの解析(プロテオミクス)が盛んに進められている。
タンパク質の構造と機能
タンパク質の機能は上記の三次構造・四次構造(立体構造)によって決定される。これは、同じアミノ酸の配列からなるタンパク質でも、立体構造(畳まれ方)によって機能が変わるということである。たとえばBSEの原因となるプリオンは、正常なプリオンとは立体構造が違うだけである。なお、多くのタンパク質では、熱や圧力を加えたり、溶液の pH 値を変える、変性剤を加えるなどの操作により二次以上の高次構造が変化し、その機能(活性)を失う。これをタンパク質の変性という。変性したタンパク質においては、疎水結合、水素結合、イオン結合の多くが破壊され、全体にランダムな構造が増加したペプチド鎖の緩んだ状態になることが知られている。タンパク質の変性は、かつて不可逆な過程であると考えられてきたが、現在では多くのタンパク質において、変性は可逆的な過程である事が確認されている。なお、変性したタンパク質を元の高次構造に戻す操作をタンパク質の再生という。タンパク質の再生は、原理としては、畳み込まれたペプチド鎖を一旦完全にほどき、数時間かけてゆっくりと畳み込むよう条件を細かく調整・変化させることで行われている。
タンパク質の折り畳み
特定のアミノ酸配列に対して、存在しうる安定な高次構造が複数存在するにもかかわらず、生体内では特定の遺伝子から特定の機能を持つ高次構造をとったタンパク質が合成できるかは、必ずしも明らかではない。クリスチャン・アンフィンセンの実験などで判明した多くのタンパク質が変性した後にもその高次構造の再生が可能なことから、一次構造それ自体が、高次構造のかなりの部分を決めていることは疑いがなく、これは「アンフィンセンのドグマ」と呼ばれる[9]。しかし、先のタンパク質の再生は数時間かかる操作(実際には、二次構造の畳み込みはかなり迅速に起こっていて、三次構造の確定に時間がかかるらしい)であるのに対し、生体内でのタンパク質の合成は数十秒から一分で完了する。さらに、発見された「アンフィンセンのドグマ」に反する事例からも、タンパク質分子を高速に畳み込み、正しい高次構造へと導く因子の存在が考えられている[9](例:タンパク質ジスルフィドイソメラーゼ、プロリンシストランスイソメラーゼ、分子シャペロン)。また、生体内では間違った立体構造をしているタンパク質はそのタンパク質のLysのアミノ基にポリユビキチンが共有結合で結合した後に、プロテアソームによって分解される。
タンパク質は周囲の環境の変化によりその高次構造を変化させ、その機能を変えることができる。タンパク質である酵素は、その触媒する反応の速度を条件に応じて変化させることができる。
立体構造の決定
上記のようなタンパク質の高次構造は、X線結晶構造解析、NMR(核磁気共鳴)、電子顕微鏡などによって測定されている。また、タンパク質構造予測による理論的推定なども行われている。タンパク質の立体構造と機能は密接な関係を持つことから、それぞれのタンパク質の立体構造の解明は、その機能を解明するために重要である。いずれ、ほしい機能にあわせてタンパク質の立体構造を設計し、合成できるようになるだろうと考えられている。
これまでの研究により構造が解明されたタンパク質については、蛋白質構造データバンク[12]によりデータの管理が行われており、研究者のみならず一般の人でもそのデータを自由に利用、閲覧できる。
物性
熱力学的安定性
タンパク質は、それぞれのアミノ酸配列に固有の立体構造を自発的に形成する。このことから、タンパク質の天然状態は熱力学的な最安定状態(最も自由エネルギーが低い状態)であると考えられている(アンフィンセンのドグマ)。
タンパク質の立体構造安定性は天然状態と変性状態の自由エネルギーの差 
- 日本蛋白質構造データバンク
- Folding@Home Science - ウェイバックマシン(2007年2月5日アーカイブ分)
- Proteins - ウェイバックマシン(2012年10月12日アーカイブ分) Medpedia「タンパク質」の項目。
- 『タンパク質』 - コトバンク
タンパク質 (ポリペプチド)
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2021/05/18 05:49 UTC 版)
「主鎖」の記事における「タンパク質 (ポリペプチド)」の解説
タンパク質(proteins)は重要な生体分子であり、ウイルス、細菌、真核細胞の構造や機能に不可欠な役割を果たしている。その骨格は、20種類のアミノ酸のそれぞれのα炭素に結合したアミノ基とカルボン酸基が重合してできたアミド結合を特徴としている。これらのアミノ酸配列は、細胞質内のリボソームによって細胞内のmRNAから翻訳される。リボソームには酵素活性があり、この酵素の指示により、連続した各アミノ酸の間にアミド結合を作る縮合反応が起こる。これは、翻訳と呼ばれる生物学的プロセス中に起こる。この酵素のメカニズムでは、共有結合したtRNAシャトルが縮合反応の脱離基として機能する。新たに遊離したtRNAは、別のペプチドを「拾い上げ」、この反応に継続的に関与することができる。ポリペプチド骨格のアミノ酸の配列は、タンパク質の一次構造として知られている。この一次構造を経て、タンパク質はバックボーンのカルボニル酸素とアミン水素の間の水素結合によって形成される二次構造へと折りたたまれる。個々のアミノ酸残基間のさらなる相互作用により、タンパク質の三次構造が形成される。そのため、ポリペプチド骨格に含まれるアミノ酸の一次構造はタンパク質の最終的な構造の「地図」であり、その生物学的機能を示している。主鎖原子の空間的な位置は、主鎖再構築のための計算ツールを使用して、α炭素の位置から再構築することができる。
※この「タンパク質 (ポリペプチド)」の解説は、「主鎖」の解説の一部です。
「タンパク質 (ポリペプチド)」を含む「主鎖」の記事については、「主鎖」の概要を参照ください。
「タンパク質」の例文・使い方・用例・文例
- 動物性タンパク質
- 良質タンパク質とビタミンCをしっかり摂取しましょう
- 1年中食べますが、夏は夏バテ防止になります。うなぎにはビタミンとタンパク質とが豊富に含まれています。
- 熱はタンパク質を変性させる。
- 動物性タンパク質は植物性タンパク質より消化率が高い。
- 細胞内タンパク質は代謝回転が速い。
- タンパク質キナーゼ
- これらの分子はタンパク質をつかむ。
- 味噌の原料となる大豆は、タンパク質を多く含む。
- その抽出物中に糖とタンパク質が含まれる。
- タンパク質のアミノ酸配列を、メッセンジャーRNAの情報を使用することによるその合成の間に、見つけ出す
- 複合タンパク質
- 共有結合を作ることでつなげる(重合体またはタンパク質の隣接したつながりの)
- ウイルスの核酸を囲むタンパク質の外側の覆い
- 20面体のタンパク質の殻の中にDNAを含み、犬と牛の疾患を引き起こす一群のウイルスの総称
- 純度が高いタンパク質とビタミンB群の源として潜在的に重要な不遊単細胞緑の藻
- 腹膜腔でタンパク質と電解質の豊かな流体の異常蓄積から関連するか、または生じるさま
- タンパク質に関して、またはそれの性質
- タンパク質と銀の化合物から成る殺菌(商標名アージロール)
- 高分子化合物とタンパク質の大きな分子の相対的な分子量を決定するために使われる高速の遠心分離機
- タンパク質のページへのリンク




