フルクトース【fructose】
フルクトース
| 分子式: | C6H12O6 |
| その他の名称: | 果糖、レブゲン、ラエボサン、ラエボラル、レブロース、フルクトステリル、Levugen、Laevoral、Laevosan、Levulose、D-Fructose、Fruit sugar、Fructosteril、Fructose、フルクトース、(3S,4R,5R)-1,3,4,5,6-Pentahydroxy-2-hexanone、D-arabino-2-Hexulose、フルクトン、Furucton、arabino-Hexulose |
| 体系名: | (3S,4R,5R)-1,3,4,5,6-ペンタヒドロキシヘキサン-2-オン、D-フルクトース、(3S,4R,5R)-1,3,4,5,6-ペンタヒドロキシ-2-ヘキサノン、D-arabino-2-ヘキスロース |
フルクトース
フルクトース
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/10/10 14:22 UTC 版)
|
|||

|
|||
| 物質名 | |||
|---|---|---|---|
|
Fructose |
|||
| 識別情報 | |||
|
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.303 | ||
| EC番号 |
|
||
| KEGG | |||
|
PubChem CID
|
|||
| UNII | |||
|
CompTox Dashboard (EPA)
|
|||
|
|
|||
|
|||
| 性質 | |||
| C6H12O6 | |||
| モル質量 | 180.16 g·mol−1 | ||
| 密度 | 1.694 g/cm3 | ||
| 融点 | 103 °C (217 °F; 376 K) | ||
| ~4000 g/L (25 °C) | |||
| 磁化率 | −102.60×10−6 cm3/mol | ||
| 熱化学 | |||
| 標準燃焼熱 ΔcH |
675.6 kcal/mol (2,827 kJ/mol)[3] (高発熱量) | ||
| 薬理学 | |||
| V06DC02 (WHO) | |||
| 危険性 | |||
| 致死量または濃度 (LD, LC) | |||
|
半数致死量 LD50
|
15000 mg/kg (静脈, ウサギ)[4] | ||
|
特記無き場合、データは標準状態 (25 °C [77 °F], 100 kPa) におけるものである。
|
|||
フルクトース(英: fructose)、または果糖(かとう、fruit sugar)は、糖の一種であり、単糖の一つで、三文字表記はFruである。水溶性の白色の結晶であり、全ての糖の中で最も多く水に溶ける[5][6]。フルクトースは、ハチミツ、木に成る果実、ベリー類、メロン、ある種の根菜に多量に含まれている。
化学的性質


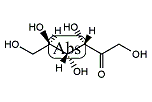
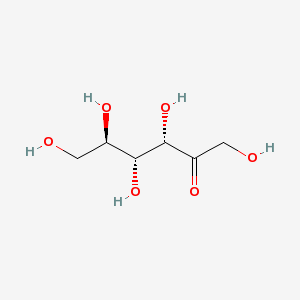
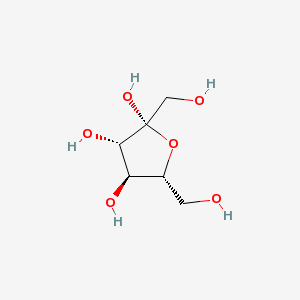
1847年、フランスのオギュスタン=ピエール・デュブランフォー (Augustin-Pierre Dubrunfaut) が初めてフルクトース分子を有機化学的に発見した[7]。フルクトースは6炭素のポリヒドロキシケトンである。グルコースの異性体であり、化学式はグルコースと同じC6H12O6であるが、構造が異なる。結晶性フルクトースはヘミケタールの安定性と分子内水素結合のため六員環構造をとる。この構造は形式的にD-フルクトピラノースと呼ばれる。40℃の水溶液中では、β-フルクトピラノース (57%)、β-フルクトフラノース (31%)、α-フルクトフラノース (9%) および少量の鎖状構造を含むその他の構造との間で化学平衡の状態にある[8]。
反応
アルコール発酵
フルクトースは、酵母およびバクテリアによって、アルコール発酵される[9]。酵母の酵素がフルクトースをエタノールと二酸化炭素に変換する[10]。発酵により発生した二酸化炭素は発酵室が開封されない限り水に溶け込み続け、炭酸との間で化学平衡となる。溶存した二酸化炭素と炭酸により炭酸発酵飲料となる。
メイラード反応
フルクトースはアミノ酸によりメイラード反応を受け、非酵素的に褐色化する。フルクトースはグルコースよりも開環構造での存在が大きいため、グルコースよりも迅速にメイラード反応の初反応が起こる。フルクトースはグルコースに比べ、約10倍も糖化反応に使われやすい[11]。したがって、フルクトースはケーキを焼くときの過度の褐色化や体積と柔軟性の減少および変異原物質の形成など、食品のおいしさならびにその他栄養学的影響の変化に寄与している可能性がある[12]。
脱水
フルクトースは容易に脱水し、ヒドロキシメチルフルフラール (HMF) を与える。この機構は今後、ガソリンや軽油の代替燃料として低コストなカーボンニュートラル系の一部となる可能性を持っている[13]。
還元性
2位にケトン基があり還元性がなさそうに見えるが、塩基性水溶液中ではロブリー・ドブリュイン-ファン エッケンシュタイン転位による異性化によりアルドースに変化し銀鏡反応、フェーリング反応を示す。中性・酸性下では酸化剤と反応しない。
異性体
D体・L体の光学異性体が考えられるが、生物にはD体のものしか存在しない。
鎖状構造のD-フルクトースのC2のケトン基は、C5もしくはC6のヒドロキシ基と容易に分子内ヘミアセタールを形成し、環状構造に変化する。環状構造の形成に伴い、C2炭素の不斉化が起こり、α, β異性体が生成する。
その結果、D体のフルクトースの環状構造には、「C5で環状化またはC6で環状化」と「α型またはβ型」の組み合わせにより、
- α-D-フルクトピラノース (α-D-fructopyranose)
- β-D-フルクトピラノース (β-D-fructopyranose)
- α-D-フルクトフラノース (α-D-fructofuranose)
- β-D-フルクトフラノース (β-D-fructofuranose)
の計4種類の構造が存在することになる。
水溶液中では,これらは鎖状構造を経由して相互に変換する。すなわち、水溶液では鎖状構造を含め、計5種類の構造の平衡混合物となる。
フルクトースが低温でより甘くなるといわれるのは、このうち最も甘味の濃いβ-D-フルクトフラノースの平衡時での割合が、低温では高く、高温では低くなるためである[14]。
-
α-D-フルクトフラノース
-
β-D-フルクトフラノース
-
α-D-フルクトピラノース
-
β-D-フルクトピラノース
-
α-L-フルクトフラノース
-
β-L-フルクトフラノース
機能
甘味

フルクトースが商業的に食品や飲料に使われる主な理由は、そのコストの低さと相対的に強い甘さである。フルクトースは天然に存在する糖の中では最も甘く、スクロースの1.73倍甘いとされている[15][16]。その甘さはピラノース型のものであり、フラノース型のものは砂糖と同程度の甘さである。フルクトースは暖めるとフラノース型が形成される[14]。フルクトースは高温ではスクロース(砂糖)の 60% の甘味度しかなく、40 ℃ 以下でないと砂糖よりも甘くならないので、フルクトースの甘さは温度によって大きく左右される。フルクトースを含む果物や転化糖は、冷やすと甘味が強くなる。
フルクトースの甘さはスクロースやデキストロースよりも早く知覚され、味の感覚はスクロースに比べより早くより強いピークに達し、早く減衰する。フルクトースは他の風味を強めることもできる[15]。
フルクトースとグルコースは末梢受容体のみならず、脳への影響レベルも異なり、食欲に対する影響も異なる。フルクトースは満腹に関連するホルモンのピークが低く、満腹感を与えにくいことが推測された[17]。
糖
砂糖
スクロース(砂糖)は、グルコース(ブドウ糖)とフルクトース(果糖)が結合した糖であり、二糖類の一種である。無色結晶、甘味を有する、水に溶けるという二糖類共通の性質を持つ。加水分解するとグルコースとフルクトースを生ずる。スクロースは、小腸壁に存在する消化酵素「サッカラーゼ(インベルターゼ)」によりグルコースとフルクトースに加水分解され、小腸で吸収されて血流に入る。この反応は短時間で起こるため、グルコースが血糖値を急激に上昇させる。
転化糖
転化糖は、酸または酵素(インベルターゼ)によって、スクロースをフルクトースおよびグルコースに加水分解した甘味料である[18]。同量の砂糖(スクロース)よりも甘いため、糖を転化させることによって砂糖の量を控えることが可能である。
異性化糖
異性化糖とは、デンプンを酵素又は酸により加水分解して得られる、主としてグルコース(ブドウ糖)からなる糖液を酵素又はアルカリにより異性化した果糖又はブドウ糖を主成分とする糖をいう[19]。デンプンはブドウ糖から構成されているが、ブドウ糖をより甘味の強い果糖に異性化させることによって甘味をより強めることができる。トウモロコシやジャガイモ、あるいはサツマイモなどのデンプンを、酵素にて糖化させた後、含まれるブドウ糖の一部を別の酵素にて果糖に異性化させたものである。
生化学
フルクトースは、グルコースに比べ開環率が高く(約10倍も糖化反応に使われやすいため[11])、生体への毒性はグルコースよりも遥かに高い。この毒性を早く消す目的で、肝臓はグルコースよりもフルクトースを優先的に処理する[20]。
フルクトースは、小腸から吸収されると、一定量までは速やかに小腸でグルコースに変換されて、門脈に入る[21]。グルコースに変換されなかったフルクトースは、門脈から肝臓に達し、肝細胞に入るとグルコースよりも速やかにフルクトキナーゼによりリン酸化されてフルクトース-1-リン酸を生成し、フルクトース-1,6-ビスリン酸を経て解糖系に入り、ピルビン酸を生成する。大量のフルクトースの摂取はピルビン酸の処理が追いつかず多量の乳酸を生じ乳酸アシドーシスを発症する場合がある。多量のフルクトースの摂取はピルビン酸を脱炭酸して多量のアセチルCoAを生じ、脂肪酸の合成に利用され、中性脂肪の生成を促進する。慢性的な中性脂肪の生成は高トリグリセリド血症をきたす。なお、空腹時には、フルクトースはフルクトース-1,6-ビスリン酸を経て糖新生に入り、66%がグルコースに変換されると言われる。また、グルコースは、門脈を経て肝細胞内に入るとリン酸化されてグルコース-6-リン酸となり、細胞内に留まることが可能となり、必要に応じて肝臓のグルコース-6-ホスファターゼによりリン酸が脱離されて再びグルコースになり細胞膜中を輸送されて肝静脈に放出される。これはグルコースの代謝量を調節するために重要であるが、フルクトースにはこのような調節機構がないことにより速やかに各種代謝が進行する[22]。
出典・注釈
- ^ Levulose comes from the Latin word laevus, levo, "left side", levulose is the old word for the most occurring isomer of fructose. D-fructose rotate plane-polarised light to the left, hence the name.[1].
- ^ Fructose - Merriam Webster dictionary
- ^ CRC Handbook of Chemistry and Physics (49th ed.). (1968–69). p. D-186
- ^ Chambers, Michael. “ChemIDplus – 57-48-7 – BJHIKXHVCXFQLS-UYFOZJQFSA-N – Fructose [USP:JAN – Similar structures search, synonyms, formulas, resource links, and other chemical information.]”. chem.sis.nlm.nih.gov. US National Institutes of Health. 2014年12月10日時点のオリジナルよりアーカイブ。2014年12月10日閲覧。
- ^ Hyvonen, L., & Koivistoinen, P (1982). “Fructose in Food Systems”. In Birch, G.G. & Parker, K.J. Nutritive Sweeteners. London & New Jersey: Applied Science Publishers. pp. 133–144. ISBN 0-85334-997-5
- ^ 20°Cでの溶解度は375.0 g/100g H2O、40°Cでは538.0 g/100g H2Oである。
- ^ Fruton, J.S. Molecules of Life 1972, Wiley-Interscience
- ^ “フルクトース(果糖)の構造”. 2011年4月12日閲覧。
- ^ McWilliams, Margaret. Foods: Experimental Perspectives, 4th Edition. ISBN 0130212822
- ^ Keusch, P. “Yeast and Sugar- the Chemistry must be right”. 2011年4月12日閲覧。
- ^ a b McPherson JD, Shilton BH, Walton DJ (March 1988). “Role of fructose in glycation and cross-linking of proteins”. Biochemistry 27 (6): 1901–7. doi:10.1021/bi00406a016. PMID 3132203.
- ^ Dills, WL (1993). “Protein fructosylation: Fructose and the Maillard reaction”. Journal of Clinical Nutrition 58: 779–787.
- ^ Huber, G. W.; Iborra, S.; Corma, A. Chem. Rev. 2006, 106, 4044 - 4098. doi:10.1021/cr068360d
- ^ a b Fructose in our diet: http://www.medbio.info/Horn/Time%201-2/carbohydrate_metabolism.htm last visited 2008-12-28
- ^ a b Hanover, LM; White, JS (1993). “Manufacturing, composition, and application of fructose”. Journal of Clinical Nutrition 58: 724s-732.
- ^ Oregon State University. "Sugar Sweetness". Last accessed May 5, 2008. http://food.oregonstate.edu/sugar/sweet.html アーカイブ 2008年5月16日 - ウェイバックマシン
- ^ JAMA 2013 Jan 2; 309:63.
- ^ ““クスリ”としての砂糖”. 独立行政法人農畜産業振興機構. 2017年7月8日閲覧。
- ^ 砂糖及びでん粉の価格調整に関する法律 - e-Gov法令検索
- ^ 山内俊一「糖質ー特にフルクトースに関してー」『痛風と核酸代謝』第34巻第2号、日本痛風・核酸代謝学会、2010年、219頁、doi:10.6032/gnam.34.219。
- ^ Jang, Cholsoon; Hui, Sheng; Lu, Wenyun; Cowan, Alexis J.; Morscher, Raphael J.; Lee, Gina; Liu, Wei; Tesz, Gregory J. et al. (2018-2). “The Small Intestine Converts Dietary Fructose into Glucose and Organic Acids” (英語). Cell Metabolism 27 (2): 351–361.e3. doi:10.1016/j.cmet.2017.12.016.
- ^ 高橋隆一 [解説]高カロリー輸液施行中に認められるアシドーシス
外部リンク
- 果糖、フルクトース - 素材情報データベース<有効性情報>(国立健康・栄養研究所)
- 国際化学物質安全性カード フルクトース (ICSC:1554) 日本語版(国立医薬品食品衛生研究所による), 英語版
フルクトース
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2021/03/30 08:44 UTC 版)
収穫時期には、果実中のフルクトース量はグルコースとほぼ同じになり、主要な糖となる。ワイン中では、フルクトースはグルコースの約2倍も甘く、デザートワインの甘味の主成分になっている。発酵中は、酵母はグルコースを最初に分解するため、温度管理や酒精強化ワイン用にブランデーを加える等して発酵を途中で中断すると、フルクトースが多く残ることになる。 ズースレゼルヴという手法では、発酵が完了した後に未発酵のムストが加えられるが、発酵を途中で中断したものよりは甘味は少ない。これは、未発酵のムストは、フルクトースとほぼ等量の甘味の少ないグルコースを含んでいるためである。同様に、スクロースを添加する補糖によっても、ワインの甘味はほとんど変化しない。
※この「フルクトース」の解説は、「ワインの糖」の解説の一部です。
「フルクトース」を含む「ワインの糖」の記事については、「ワインの糖」の概要を参照ください。
「フルクトース」の例文・使い方・用例・文例
固有名詞の分類
- フルクトースのページへのリンク