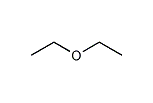
ジエチル‐エーテル【diethyl ether】
ジエチルエーテル
| 分子式: | C4H10O |
| その他の名称: | エーテル、酸化エチル、麻酔エーテル、エチルエーテル、エトキシエタン、Ether、Ethyl ether、Ethyl oxide、Ethoxyethane、Diethyl ether、Anesthetic ether、1,1'-Oxybisethane、Solvent ether、RCRA waste number U-117、Diethyl oxide、Anaesthetic ether、Aether、溶剤エーテル、ジエチルオキシド、プロナルコール、Anesthesia ether、Pronarcol、1-Ethoxyethane |
| 体系名: | 1,1'-オキシビスエタン、ジエチルエーテル、1-エトキシエタン |
ジエチルエーテル
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2024/11/15 14:27 UTC 版)
| ジエチルエーテル | |
|---|---|
 |
|
 |
|
 |
|
|
Ethoxyethane
|
|
|
別称
|
|
| 識別情報 | |
| CAS登録番号 | 60-29-7  |
| PubChem | 3283 |
| ChemSpider | 3168  |
| UNII | 0F5N573A2Y  |
| EC番号 | 200-467-2 |
| 国連/北米番号 | 1155 |
| KEGG | D01772  |
| ChEBI | |
| ChEMBL | CHEMBL16264  |
| RTECS番号 | KI5775000 |
| バイルシュタイン | 1696894 |
| Gmelin参照 | 25444 |
|
|
|
|
| 特性 | |
| 化学式 | C4H10O |
| モル質量 | 74.12 g mol−1 |
| 外観 | 無色の液体 |
| 匂い | ドライラムのような甘い香り[1] |
| 密度 | 0.7134 g/cm3, 液体 |
| 融点 | −116.3 °C, 157 K, -177 °F |
| 沸点 | 34.6 °C, 308 K, 94 °F [3] |
| 水への溶解度 | 6.05 g/(100 mL)[2] |
| log POW | 0.98 |
| 蒸気圧 | 440 mmHg (58.66 kPa) at 20 °C[1] |
| 磁化率 | −55.1·10−6 cm3/mol |
| 屈折率 (nD) | 1.353 (20 °C) |
| 粘度 | 0.224 cP (25 °C) |
| 構造 | |
| 双極子モーメント | 1.15 D (気体) |
| 熱化学 | |
| 標準生成熱 ΔfH |
−271.2 ± 1.9 kJ/mol |
| 標準燃焼熱 ΔcH |
−2732.1 ± 1.9 kJ/mol |
| 標準モルエントロピー S |
253.5 J/(mol·K) |
| 標準定圧モル比熱, Cp |
172.5 J/(mol·K) |
| 危険性 | |
| 安全データシート(外部リンク) | External MSDS |
| GHSピクトグラム |   |
| GHSシグナルワード | 危険(DANGER) |
| Hフレーズ | H224, H302, H336 |
| Pフレーズ | P210, P233, P240, P241, P242, P243, P261, P264, P270, P271, P280, P301+312, P303+361+353, P304+340 |
| 主な危険性 | 可燃性が非常に高い、皮膚に有害、空気中と光により爆発性の過酸化物に分解する[1] |
| NFPA 704 | |
| 引火点 | −45 °C (−49 °F; 228 K) [5] |
| 発火点 | 160 °C (320 °F; 433 K) [5] |
| 爆発限界 | 1.9 – 48.0%[6] |
| 許容曝露限界 | TWA 400 ppm (1200 mg/m3)[1] |
| 最低致死濃度 LCLo | 106,000 ppm (ウサギ) 76,000 ppm (イヌ)[4] |
| 半数致死濃度 LC50 | 73,000 ppm (ラット, 2時間) 6500 ppm (マウス, 1.65時間)[4] |
| 関連する物質 | |
| 関連するエーテル | |
| 関連物質 |
|
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
ジエチルエーテル(英: diethyl ether)とは、エチル基とエチル基がエーテル結合した分子構造をしている有機化合物である。密度は0.708 g/cm3。特徴的な甘い臭気を持つ、無色透明の液体である。単にエーテルというときはこのジエチルエーテルのことを指す場合が多い。エチルエーテルとも呼ばれる。溶媒や燃料として使われる。かつては吸入麻酔薬としても使われた。
利用
有機溶媒
溶媒抽出法に用いられる。水にやや溶けやすく、オクタノール/水分配係数は0.89。比重が水より小さいため、有機層は水層の上に位置する。グリニャール反応などの有機金属化学の溶剤としてもよく使われる。またアセチルセルロースなどの合成に使われる。
麻酔薬
有害性が問題視されたクロロホルムに替わる吸入麻酔薬として、医療用麻酔に用いられた。
特徴として、導入(意識を失うまでの所要時間)が遅く、筋弛緩作用が強く、呼吸器や循環系への抑制作用は弱く、また7 - 10 %の気体濃度で使用するため酸素欠乏に陥りにくい[7]。 さらに、麻酔深度の調節全域(マージン)が極めて広く、致死量が高いことから、導入に他の麻酔薬を適用し、維持麻酔薬として使う手法が確立されていた。
しかし、極めて引火点が低く、低い誘電率から静電気を帯びやすいため、密閉され電子機器が並ぶ近代的な手術室ではガス爆発リスクが高く、先進国では使用されなくなっている。発展途上国では現在も維持麻酔薬の主流であるが、新興国では手術室の改善が先行したがゆえの爆発死亡事故が複数生じている[要出典]。
副作用としては、刺激性が強いため咳の原因となり、唾液腺や気管支を刺激して多量に唾液などの分泌物を分泌させることがあり、吸引の準備が一般的である。
燃料
ジエチルエーテルは発火点が低く(160 ℃)、セタン価が85 - 96と高いことから、ディーゼルエンジンの燃焼助剤として利用できる。
飲用
19世紀から20世紀初頭にかけて、エタノールの代替品としてエーテルの飲用が行われることがあった。飲用の効果はエタノールとよく似ており、始めは上機嫌になり、そのうち酩酊して眠ってしまう。特にアイルランドでは禁酒運動家がエタノールの代替として許容されると考えたために大流行したが、ロシアやフランスなどでも流行していた。アメリカ合衆国では、エタノールよりも害が少ないと考えられ、医師の会合から結婚式や裁縫会に至るまで幅広く飲まれていた[8]。
実際にはエタノールの数倍程度の経口毒性があり、ヒトにおける最小致死量は260 mg/kgである。
ポーランドでは、湯で割って、少量の砂糖、蜂蜜、シナモン、クローブなどを加えて飲まれた。鉱夫らはコーヒーやラズベリージュースに加えて飲んでいた。ストレートで少しずつ飲むのは、効きが良いが危険な方法である。エーテルは体温で沸騰するためしゃっくりを引き起こし、極端な場合には胃が破裂することもあった[9]。
合成
ジエチルエーテルは酸を触媒としてエタノールの脱水縮合で合成できる。エタノールを硫酸のような強酸と混ぜると、酸が解離してヒドロニウムイオンが生じる。 これがエタノールの酸素原子をプロトン化することで、エタノール分子は正電荷を持つ。
外部リンク
固有名詞の分類
- ジエチルエーテルのページへのリンク