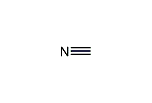シアンか‐すいそ〔‐クワ‐〕【シアン化水素】
青酸
シアン化水素
| 化合物名や化合物に関係する事項: | サイトカイニン シアロ糖脂質 シアン化カリウム シアン化水素 シアン化物 ショ糖 ジデオキシリボヌクレオシド |
シアン化水素
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/07/13 07:20 UTC 版)
| シアン化水素 | |
|---|---|
 |
|
 |
 |
 |
|
|
別称
|
|
| 識別情報 | |
|
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.000.747 |
| EC番号 |
|
| KEGG | |
| MeSH | Hydrogen+Cyanide |
|
PubChem CID
|
|
| RTECS number |
|
| UNII | |
| 国連/北米番号 | 1051 |
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
|
| 特性 | |
| 化学式 | HCN |
| モル質量 | 27.0253 g/mol |
| 外観 | 無色の液体または気体 |
| 匂い | ビターアーモンドのような[3] |
| 密度 | 0.6876 g/cm3[4] |
| 融点 | -13.29 °C, 260 K, 8 °F [4] |
| 沸点 | 26 °C, 299 K, 79 °F [4]:4.67 |
| 水への溶解度 | 混和 |
| エタノールへの溶解度 | 混和 |
| 蒸気圧 | 100 kPa (25 °C)[4]:6.94 |
| kH | 75 μmol Pa−1 kg−1 |
| 酸解離定数 pKa | 9.21 (水中), 12.9 (DMSO中)[5] |
| 塩基解離定数 pKb | 4.79 (シアニドアニオン) |
| 屈折率 (nD) | 1.2675[6] |
| 粘度 | 0.183 mPa·s (25 °C)[4]:6.231 |
| 構造 | |
| 正方晶系(>170 K) 直方晶系(<170 K)[7] |
|
| C∞v | |
| 直線 | |
| 2.98 D | |
| 熱化学 | |
| 標準生成熱 ΔfH |
135.1 kJ mol−1 |
| 標準モルエントロピー S |
201.8 J K−1 mol−1 |
| 標準定圧モル比熱, Cp |
35.9 J K−1 mol−1 (気体)[4]:5.19 |
| 危険性 | |
| GHS表示: | |
    |
|
| Danger | |
| H225, H300+310+330, H319, H336, H370, H410 | |
| P210, P261, P305+351+338 | |
| NFPA 704(ファイア・ダイアモンド) | |
| 引火点 | −17.8 °C (0.0 °F; 255.3 K) |
| 538 °C (1,000 °F; 811 K) | |
| 爆発限界 | 5.6% – 40.0%[8] |
| 致死量または濃度 (LD, LC) | |
|
半数致死濃度 LC50
|
501 ppm (ラット, 5 分) 323 ppm (マウス, 5 分) 275 ppm (ラット, 15 分) 170 ppm (ラット, 30 分) 160 ppm (ラット, 30 分) 323 ppm (ラット, 5 分)[9] |
|
LCLo (最低致死濃度)
|
200 ppm (哺乳類, 5 分) 36 ppm (哺乳類, 2 時間) 107 ppm (ヒト, 10 分) 759 ppm (ウサギ, 1 分) 759 ppm (ネコ, 1 分) 357 ppm (ヒト, 2 分) 179 ppm (ヒト, 1 時間)[9] |
| NIOSH(米国の健康曝露限度): | |
|
PEL
|
TWA 10 ppm (11 mg/m3) [皮膚][8] |
|
REL
|
ST 4.7 ppm (5 mg/m3) [皮膚][8] |
|
IDLH
|
50 ppm[8] |
| 関連する物質 | |
| 関連するアルカンニトリル | |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
シアン化水素(Hydrogen Cyanide)は、メタンニトリル、ホルモニトリル、 蟻酸ニトリルとも呼ばれる猛毒の物質である。その水溶液は弱酸性を示し、シアン化水素酸と呼ばれる。
相で区別する場合、気体のシアン化水素は青酸ガスと呼び、液体は液化青酸と呼ぶ。 気体、液体、水溶液のいずれについても、慣習的に青酸(せいさん)と呼ばれる。この語は紺青に由来する。
なお、シアン酸は異なる物質である。 また、ドイツ語のシアン(ドイツ語: Cyan、英語: Cyanogen)はジシアンに等しい。
また、日本においては毒物及び劇物取締法第二条によって指定されている毒物の一種である。
性質
物理的性質
シアン化水素は可燃性の気体であり、爆発範囲 (5.6〜40.0パーセント) を持ち、常圧における沸点が常温付近のため、 気温が低いと液状、高いと気体になる。ただし液体でも揮発性が非常に高く、一部が気体として揮発してくるため、 低温時でも中毒の原因となる。
なお、シアン化水素が水に溶けて、シアン化水素酸になった場合は、水分子との高い親和力により液化青酸よりも気化し難い。
シアン化水素の分子は極性を有するため、液化したシアン化水素は比誘電率が高く、18 ℃で118.8であり、 極性を有した物質に対して優れた溶媒として用いる事も可能である。しかし、シアン化水素の毒性のため、 溶媒としての取り扱いには細心の注意を要する。
化学的性質
シアン化水素の炭素原子と窒素原子は、三重結合で結合している。 炭素よりも窒素の方が電気陰性度が高く、この結果、窒素の側に電子の存在確率が偏るために、分子は極性を持つ。 この部分は、官能基で言えばニトリルと呼ばれる構造である。しかし、 シアン化水素の場合、極性溶媒の中ではシアン化水素酸としてプロトンを電離するなど、一般的なニトリルとは性質が異なる。 なお、シアン化水素酸の酸解離定数は、18 ℃において、Ka = 1.3 × 10−9である [注釈 1] 。
シアン化水素酸がプロトンを電離した陰イオン(CN−)をシアン化物イオンと呼び、 特に遷移金属のイオンに配位して、錯体を形成し易いため、錯体化学の分野では重要なイオンである [注釈 2] 。 そして、この遷移金属元素に配位し易いというシアン化物イオンの性質こそが、シアン化水素の毒性発現の原因でもある。 また、この遷移金属元素に配位し易い性質を利用して、 ヒドロキソコバラミンを静脈注射し、シアン化物イオンをヒドロキソコバラミンの遷移金属元素に配位させて、 シアン化物イオンの毒性解除を狙う治療が実施される場合がある。
燃焼
シアン化水素を空気中で強熱すると、炎を上げて燃え、窒素と二酸化炭素と水になる。 炎色は桃色(『化学辞典普及版』森北出版)・青色(『化学辞典』東京化学同人)・紫色(『実験化学ガイドブック』丸善)と各種の表記が見られるものの、 概ね赤紫色と呼べる。なお、原子吸光分析で燃料ガスとして、シアン化水素ガスボンベを使用する事がある。
「シアン化水素」の例文・使い方・用例・文例
シアン化水素と同じ種類の言葉
- シアン化水素のページへのリンク