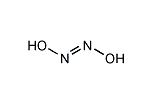
ジアゼンジオール
次亜硝酸
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/07/16 06:07 UTC 版)
| 次亜硝酸 | |
|---|---|
 |
|
 |
 |
|
Diazenediol
|
|
|
N-(Hydroxyimino)hydroxylamine
|
|
|
別称
Hyponitrous acid dimer
|
|
| 識別情報 | |
|
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| Gmelin参照 | 141300 |
| KEGG | |
|
PubChem CID
|
|
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| 特性 | |
| 化学式 | H2N2O2 |
| モル質量 | 62.0282 g/mol |
| 外観 | 白色の結晶 |
| 危険性 | |
| 労働安全衛生 (OHS/OSH): | |
|
主な危険性
|
乾燥時爆発性 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
次亜硝酸(じあしょうさん、英語: hyponitrous acid)は、化学式がH2N2O2 または、 HON=NOH の化合物である。ニトロアミド(ニトロアミン) H2N−NO2 の異性体で、アザノン HNO の二量体である。
次亜硝酸は、[ON=NO]2−アニオンを含む次亜硝酸塩と、[HON=NO]−アニオンを含む酸性次亜硝酸塩の2つの系列の塩を形成する[1]。
構造と性質
trans体 と cis体の構造をとることができる。trans-次亜硝酸は白色の結晶を形成し、乾燥すると爆発する。水溶液中では、弱酸(pKa1 = 7.21, pKa2 = 11.54)であり[2]、pH 1-3、25 ℃で半減期16日で亜酸化窒素と水に分解する。
この反応は可逆的ではないので、N2OはH2N2O2の無水物と考えるべきではない[1]。 cis-体は知られていないが[1]、そのナトリウム塩(次亜硝酸ナトリウム)が得られる[3]。
合成
次亜硝酸 (trans) は、ジエチルエーテル中、次亜硝酸銀と無水塩酸から合成できる。
分光学的データから、得られた酸がtrans配置であることが示されている[3]。
生物学的観点
次亜硝酸レダクターゼは以下の化学反応を触媒する酵素である[4]。
出典
- ^ a b c Wiberg, Egon; Holleman, Arnold Frederick (2001). Inorganic Chemistry. Elsevier. ISBN 0-12-352651-5
- ^ Perrin, D. D., ed (1982). Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution. IUPAC Chemical Data (2nd ed.). Oxford: Pergamon (1984発行). Entry 120. ISBN 0-08-029214-3. LCCN 82--16524
- ^ a b Catherine E. Housecroft; Alan G. Sharpe (2008). “Chapter 15: The group 15 elements”. Inorganic Chemistry (3rd ed.). Pearson. p. 468. ISBN 978-0-13-175553-6
- ^ “ENZYME - 1.7.1.5 Hyponitrite reductase”. 2024年7月6日閲覧。
関連項目
次亜硝酸と同じ種類の言葉
- 次亜硝酸のページへのリンク