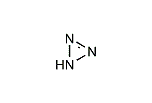ヒドラゾ酸
アジ化水素
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/07/13 07:24 UTC 版)
| アジ化水素 | |
|---|---|
 |
|
 |
|
 |
|
|
Hydrogen azide |
|
|
別称
Hydrogen azide
Azoimide Azic acid |
|
| 識別情報 | |
|
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.029.059 |
| EC番号 |
|
| Gmelin参照 | 773 |
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| 特性 | |
| 化学式 | HN3 |
| モル質量 | 43.03 g mol−1 |
| 外観 | 無色、揮発性の高い液体 |
| 密度 | 1.09 g/cm3 |
| 融点 | -80 °C, 193 K, -112 °F |
| 沸点 | 37 °C, 310 K, 99 °F |
| 水への溶解度 | 溶けやすい |
| 溶解度 | アルカリ、エタノール、ジエチルエーテルに溶ける |
| 酸解離定数 pKa | 4.6 [1] |
| 構造 | |
| ほぼ直線 | |
| 危険性 | |
| 労働安全衛生 (OHS/OSH): | |
|
主な危険性
|
猛毒性、爆発性、反応性 |
| GHS表示: | |
   |
|
| Danger | |
| H200, H319, H335, H370 | |
| P201, P202, P260, P261, P264, P270, P271, P280, P281, P304+340, P305+351+338, P307+311, P312, P321 | |
| NFPA 704(ファイア・ダイアモンド) | |
| 関連する物質 | |
| その他の 陽イオン |
アジ化ナトリウム アジ化リチウム アジ化カリウム |
| 関連する水素化窒素 | アンモニア ヒドラジン |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
アジ化水素(—かすいそ、英語: hydrogen azide)は、化学式が HN3 で表される無機酸の一種[2]。アジ化水素酸(英語: hydrazoic acid)、アゾイミド(英語: azoimide)[3]とも呼ばれる。刺激臭を有する無色透明の液体。爆発性を有する。CAS登録番号は [7782-79-8]。
シアン化水素(青酸)並みの猛毒で、皮膚、粘膜などを刺激する。取り扱いには適切な設備と厳重な管理を要する。
歴史
アジ化水素は1890年、テオドール・クルチウスにより最初に単離された[4]。
化学的性質
アジ化水素は弱酸性を持つ (pKa 4.6–4.7)。水に溶けやすく、水溶液は多くの金属(亜鉛、鉄など)を、水素を放出しながら溶かす。そのとき、金属のアジ化物を生成する。
多くの金属アジ化物には爆発性が知られる。また、無水物の結晶は加熱により分解し、金属の純品を与える。鉛や銀、水銀のアジ化物は水に難溶であり、そのことはハロゲン化水素とアジ化水素との類似点である。アジ化物はまた、ヨウ化アルキルと容易に反応する。
カルボン酸ハロゲン化物やアルデヒド、ケトンなどに作用させると、シュミット反応を引き起こす。
製造
アジ化水素はアジ化ナトリウムなどの塩に酸を作用させて得る。
毒性
毒性は青酸に匹敵し、後遺症の報告もある[5]。アジ化水素は揮発性と高い毒性を持つ。蒸気を吸い込むと、刺激臭を感じるとともに激しい頭痛に見舞われる。蓄積性はない。
アジ化ナトリウムが胃酸と反応し、アジ化水素を発生させ、治療者に二次被害を与える危険性がある[6]。日本でも、医療スタッフに二次被害が発生した事例がある[6]。
脚注
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ Dictionary of Inorganic and Organometallic Compounds. Chapman & Hall
- ^ Chisholm, Hugh, ed. (1911). . Encyclopædia Britannica (英語). Vol. 3 (11th ed.). Cambridge University Press. pp. 82–83. This also contains a detailed description of the contemporaneous production process.
- ^ Curtius, Th. Berichte 1890, 23, 3023.
- ^ 宮川定吉「アジ化水素による中毒の後遺症と判断される1例について」『産業医学』第20巻第5号、社団法人日本産業衛生学会、1978年、267-277頁、doi:10.1539/joh1959.20.276。
- ^ a b 広瀬保夫,畑耕治郎,本多拓,山崎芳彦,堀寧,大関暢「アジ化ナトリウム集団中毒症例の検討」『日本救急医学会雑誌』第12巻第3号、日本救急医学会、2001年、125-129頁、doi:10.3893/jjaam.12.125。
関連項目
参考文献
 ウィキメディア・コモンズには、アジ化水素に関するカテゴリがあります。
ウィキメディア・コモンズには、アジ化水素に関するカテゴリがあります。- OSHA: Hydrazoic Acid Archived 2008-04-04 at the Wayback Machine.
「アジ化水素」の例文・使い方・用例・文例
アジ化水素と同じ種類の言葉
- アジ化水素のページへのリンク