過塩素酸
過塩素酸
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2023/06/29 22:51 UTC 版)
| 過塩素酸 | |
|---|---|
 |
 |
|
過塩素酸 |
|
| 識別情報 | |
| CAS登録番号 | 7601-90-3 |
| RTECS番号 | SC7500000 |
|
|
| 特性 | |
| 化学式 | HClO4 |
| モル質量 | 100.46 g mol−1 |
| 外観 | 無色の液体 |
| 密度 | 1.768 g cm-3 (22 °C) |
| 融点 | 19 °C/11 mmHg[1] |
| 沸点 | 203 °C(共沸)[1] |
| 水への溶解度 | 任意に混和 |
| 酸解離定数 pKa | -8.6 (-9.9) |
| 熱化学 | |
| 標準生成熱 ΔfH |
-40.58 kJ mol-1[2] |
| 標準モルエントロピー S |
188.4 J mol-1K-1 |
| 危険性 | |
| EU分類 | 酸化性 (O) 腐食性 (C) |
| NFPA 704 | |
| Rフレーズ | R5 R8 R35 |
| Sフレーズ | S1/2 S23 S26 S36 S45 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
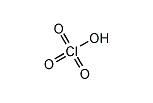
過塩素酸(かえんそさん、英: perchloric acid)とは、塩素のオキソ酸の一種で、化学式 HClO4 と表される過ハロゲン酸。水に溶けやすい無色の液体。酸化数7価の塩素に、ヒドロキシ基(-OH)1個とオキソ基(=O)3個が結びついた構造を持つ。
塩素酸より酸素が1個多く、名称に「過/per」と付いているものの分子内に -O-O- 結合はなく本来の塩素原子の最高酸化状態であり過酸ではない。
概要
硫酸、硝酸などと同様に強酸であり、本来は酸素原子の誘起効果により非常に強い酸であるが、希薄水溶液中では水平化効果により塩酸および硝酸などと電離度に著しい差は認められない。過塩素酸は日本の消防法第2条第7項及び別表第一第6類1号により危険物第6類(酸化性液体)に指定されている。
製法
過塩素酸イオン(かえんそさんいおん、英: perchlorate、ClO−
4)は過塩素酸の電離により生成する1価の陰イオンである。過塩素酸塩結晶中にも存在し、正四面体形構造をとり Cl-O 間結合距離は過塩素酸ナトリウム結晶中で142.0-143.1 pmであり、類似構造の硫酸イオン (149 pm) と比較して短く、より二重結合性が強いと考えられていた(形式的な結合次数は1.75)。このような結合長をもとに、過塩素酸イオンの結合はCl原子が3つのO原子と二重結合を作り、もう一つのOと単結合を作っているという極限構造(の共鳴状態)で書かれることが多い。しかしその一方で、理論計算からはCl3+に4つのO−が単結合で結びついているというオクテット則を満たす描像がもっとも現実の系に近いと示唆されている[7]。この場合、結合が通常の単結合より短く強い点に関しては、ClとOの電気陰性度の差が大きい事により結合が強く分極していることとそれぞれの原子が電荷を持つ事によりCl-O間にクーロン力によるイオン結合がプラスされていると説明される。近年、理論計算から同様の予想がなされていた硫酸などにおいても実際にS-O結合が単結合であること、その結合が単結合より短く強いのは分極した単結合におけるクーロン引力によるものであることが実験的に確認され、過塩素酸イオンのCl-O結合が単結合であるという理論的予測が間接的に支持されている。
希薄水溶液中では安定でありほとんど酸化作用を示さないが、潜在的に高い酸化作用をもち、その標準酸化還元電位は以下の通りである。
「過塩素酸」の例文・使い方・用例・文例
- 過塩素酸の塩
固有名詞の分類
- 過塩素酸のページへのリンク