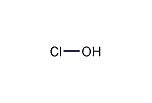次亜塩素酸
次亜塩素酸
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2023/09/20 02:11 UTC 版)
| 次亜塩素酸 | |
|---|---|
 |
|
 |
|
|
hypochlorous acid |
|
| 識別情報 | |
| CAS登録番号 | 7790-92-3  |
| PubChem | 24341 |
| ChemSpider | 22757  |
| UNII | 712K4CDC10  |
| EC番号 | 232-232-5 |
|
|
|
|
| 特性 | |
| 化学式 | HClO |
| モル質量 | 52.46 g mol−1 |
| 外観 | 無色水溶液 |
| 密度 | 可変 |
| 水への溶解度 | 可溶 |
| 酸解離定数 pKa | 7.53[1] |
| 危険性 | |
| 主な危険性 | 酸化剤 (O) |
| 関連する物質 | |
| 関連物質 | 塩素 次亜塩素酸カルシウム 次亜塩素酸ナトリウム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
次亜塩素酸(じあえんそさん、英: hypochlorous acid)は塩素のオキソ酸の1つで、組成式では HClO と表されるが、水素原子と塩素原子が酸素原子に結合した構造 H-O-Cl を持つ。塩素の酸化数は+1である(亜塩素酸よりも酸化数が少ないため「次亜」が付く)。
不安定な物質であり、水溶液中で徐々に分解する。次亜塩素酸および次亜塩素酸の塩類は酸化剤、漂白剤、外用殺菌剤、消毒剤として利用される。
なお、化学式は、IUPAC(国際純粋および応用化学連合)2005年勧告に従えばHOClと表記されるが、ここでは、慣用のHClOを用いる。
性質
実験室的には水酸化カリウム水溶液などに塩素を通じたりして調製した次亜塩素酸塩水溶液を硫酸で中和し、水蒸気蒸留して遊離酸の水溶液を得る。また、酸化水銀(II) の四塩化炭素懸濁液に塩素を通じた後に水で抽出したり、あるいは酸化ビスマスを水懸濁液中に塩素を通じることで遊離酸の水溶液を得る方法も知られている。
薄い水溶液としては存在するが、25 %以上の濃度では一酸化二塩素に変化するので遊離酸を単離することはできない。濃厚水溶液は淡黄色である。また、遊離酸が弱酸 (pKa = 7.53)[2] のため、次亜塩素酸ナトリウムなどの次亜塩素酸塩水溶液はかなり強い塩基性を示す。
水溶液中でも不安定で、次のような不均化により塩化水素を放出しながら徐々に分解する。特に酸性物質水溶液と化合するとこの分解が促進される。
「次亜塩素酸」の例文・使い方・用例・文例
次亜塩素酸と同じ種類の言葉
- 次亜塩素酸のページへのリンク