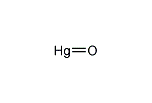水銀(II)オキシド
酸化水銀(II)
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/11/03 14:01 UTC 版)

|
|

|
|
| 物質名 | |
|---|---|
|
酸化水銀(II) |
|
|
別名
酸化水銀 |
|
| 識別情報 | |
|
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.040.580 |
| KEGG | |
|
PubChem CID
|
|
| RTECS number |
|
| UNII | |
| 国連/北米番号 | 1641 |
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| 性質 | |
| HgO | |
| モル質量 | 216.591 g·mol−1 |
| 外観 | 赤色または黄色結晶 |
| 匂い | 無臭 |
| 密度 | 11.14 g/cm3 |
| 融点 | 500 °C (932 °F; 773 K) (分解) |
| 0.0053 g/100 mL (25 °C) 0.0395 g/100 mL (100 °C) |
|
| 溶解度 | エタノール、ジエチルエーテル、アセトン、アンモニアに溶けない。 |
| バンドギャップ | 2.2 eV[1] |
| 磁化率 | −44.0·10−6 cm3/mol |
| 屈折率 (nD) | 2.5 (550 nm)[1] |
| 熱化学 | |
| 標準モルエントロピー S⦵ | 70 J·mol−1·K−1[2] |
|
標準生成熱 (ΔfH⦵298)
|
−90 kJ·mol−1[2] |
| 危険性 | |
| 労働安全衛生 (OHS/OSH): | |
|
主な危険性
|
極めて毒性が高い、環境汚染物質 |
| GHS表示:[4] | |
   |
|
| Danger | |
| H300+H310+H330, H372, H410 | |
| P260, P262, P264, P270, P271, P273, P280, P284, P301+P316, P302+P352, P304+P340, P316, P320, P321, P330, P361+P364, P391, P403+P233, P405, P501 | |
| NFPA 704(ファイア・ダイアモンド) | |
| 引火点 | 不燃性 |
| 致死量または濃度 (LD, LC) | |
|
半数致死量 LD50
|
18 mg/kg (経口, ラット)[3] |
| 安全データシート (SDS) | ICSC 0981 |
| 関連する物質 | |
| その他の 陰イオン |
硫化水銀(II) セレン化水銀(II) テルル化水銀(II) |
| その他の 陽イオン |
酸化亜鉛 酸化カドミウム |
|
特記無き場合、データは標準状態 (25 °C [77 °F], 100 kPa) におけるものである。
|
|
酸化水銀(II)(さんかすいぎん(II)、Mercury(II) oxide)は、化学式が HgO と表される水銀の酸化物である。赤色の赤降汞(せきこうこう)と黄色の黄降汞(おうこうこう)とが存在するが、粒子の大きさの違いによるものでX線回折により同一の結晶構造(斜方晶系)であることが判明している。いずれも O-Hg-O が直線で O で屈曲したジグザク状の平面構造に配列している。またやや不安定な六方晶系の多形も存在する。
合成
酸素中で水銀を 350 ℃ に加熱すると生成するが、さらに加熱すると、400 ℃ で黒変し 500 ℃ で水銀と酸素とに分解する[6]。あるいは光照射によっても分解する。
酸化水銀(II)を得るには硝酸水銀(II)の熱分解、水銀の陽極酸化、水銀(II)塩水溶液に塩基または炭酸塩を加えても製造できる。すなわち、硝酸水銀(II)の熱分解や水銀の直接酸化では、赤色酸化水銀(II)が生成するのに対して Hg2+ の水溶液に OH- を加えると黄色酸化水銀(II)が沈殿する。
酸化水銀(II)はハロゲン化アルカリ金属、例えばヨウ化カリウム溶液に溶けテトラヨード水銀(II)酸カリウムなどに複分解し塩基性を示す。
- 酸化水銀(II)のページへのリンク