トリフルオロアミン
三フッ化窒素
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/10/20 10:10 UTC 版)

|
|

|
|
| 物質名 | |
|---|---|
|
Nitrogen trifluoride |
|
|
別名
Nitrogen fluoride |
|
| 識別情報 | |
|
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.029.097 |
| EC番号 |
|
| Gmelin参照 | 1551 |
|
PubChem CID
|
|
| RTECS number |
|
| UNII | |
| 国連/北米番号 | 2451 |
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| 性質 | |
| NF3 | |
| モル質量 | 71.00 g/mol |
| 外観 | 無色の気体 |
| 匂い | カビのような |
| 密度 | 3.003 kg/m3 (1 atm, 15 °C) 1.885 g/cm3 (沸点、液体) |
| 融点 | −207.15 °C (−340.87 °F; 66.00 K) |
| 沸点 | −129.06 °C (−200.31 °F; 144.09 K) |
| 0.021 g/100 mL | |
| 蒸気圧 | 44.0 atm[1](−38.5 °F または −39.2 °C または 234.0 K)[注釈 1] |
| 屈折率 (nD) | 1.0004 |
| 構造 | |
| 三角錐 | |
| 0.234 D | |
| 熱化学 | |
| 標準定圧モル比熱, Cp |
53.26 J/(mol·K) |
| 標準モルエントロピー S |
260.3 J/(mol·K) |
| 標準生成熱 ΔfH |
−31.4 kcal/mol[2] −109 kJ/mol[3] |
|
ギブズの 自由エネルギー (ΔfG⦵) |
−84.4 kJ/mol |
| 危険性 | |
| GHS表示: | |
| H270, H280, H332, H373 | |
| P220, P244, P260, P304+P340, P315, P370+P376, P403 | |
| NFPA 704(ファイア・ダイアモンド) | |
| 引火点 | 不燃性 |
| 致死量または濃度 (LD, LC) | |
|
半数致死濃度 LC50
|
2000 ppm (マウス, 4 時間) 9600 ppm (イヌ, 1 時間) 7500 ppm (サル, 1 時間) 6700 ppm (ラット, 1 時間) 7500 ppm (マウス, 1 時間)[5] |
| NIOSH(米国の健康曝露限度): | |
|
PEL
|
TWA 10 ppm (29 mg/m3)[4] |
|
REL
|
TWA 10 ppm (29 mg/m3)[4] |
|
IDLH
|
1000 ppm[4] |
| 安全データシート (SDS) | AirLiquide |
|
特記無き場合、データは標準状態 (25 °C [77 °F], 100 kPa) におけるものである。
|
|
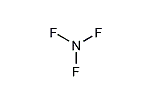
三フッ化窒素(さんフッかちっそ)は化学式 NF3で表される無機化合物。この窒素-フッ素化合物は無色、有毒、無臭、不燃性、助燃性の気体である。半導体化学でエッチングガスとして使われるため、使用は増加傾向にある。
用途
三フッ化窒素はシリコンウェハーのプラズマエッチングに使われる。特に液晶ディスプレイやシリコンベースの太陽電池フィルム用のプラズマCVD処理室の洗浄に使われる。このガスが分解してできるフッ素のラジカルがポリシリコンや窒化ケイ素や二酸化ケイ素と反応して分解させる。三フッ化窒素はケイ化タングステン(タングステンシリサイド、WSi2)と一緒に化学気相成長させて、タングステンを作るのにも使われる。NF3は当初、ヘキサフルオロエタンや六フッ化硫黄のようなパーフルオロカーボンと比べて環境に与える悪影響が少ないと考えられていた[6] 。近年フッ素ガスが、三フッ化窒素よりも環境への負荷が小さい代替品として、フラットパネルや太陽電池の量産工程用として導入されている[7]。 三フッ化窒素は取り扱いの容易さと安定性から、化学レーザーの一種であるフッ化水素レーザーに用いられる。
合成方法と反応性
二元素から成るフッ化物の中で、NF3 はフッ素と窒素からは直接合成できない珍しい例である。ほとんどの元素はフッ素ガスと反応し、時には激しく反応する。しかし、N2 と F2 とを直接反応させることはできない。
NF3 を初めて合成したのはオットー・ラフであり、ラフは1903年に始めた最初の取り組みから25年後の1928年に、フッ化アンモニウムとフッ化水素の溶融混合物を電気分解するという方法を使って NF3 を得ることができた[8]。これにより、三フッ化窒素は三塩化窒素よりもはるかに反応性が低いことが判明した。今日では、アンモニアとフッ素ガスを反応させる方法を使ったり、ラフの方法を改良した方法を使ったりする[9] 。
NF3は気体であり、高圧ボンベに入れて輸送される。
反応
NF3は水にわずかに溶ける。水と反応することはない。NF3の双極子モーメントは小さく、0.2340 D である。一方 NH3 は塩基性であり、双極子モーメントは 1.47 D と高い[10]。
NF3は弱い酸化剤としてはたらく。
塩化水素と反応して塩素を発生する:
高温で金属に接触すると、テトラフルオロヒドラジンを発生する。
NF3はフッ素、五フッ化アンチモンと反応してテトラフルオロアンモニウム塩を発生する:
温室効果ガス
NF3 は温室効果ガスの一種だが、使用量が少ないため、SF6 やパーフルオロカーボンと比較して地球の大気に対する環境に与える影響は小さいと言われてきた[11][12]。NF3の地球温暖化係数(GWP)はCO2の17,200倍である[13][14][15]。NF3 の温室効果ガスとしての寿命は740年である[13]。NF3 は排出量が少ないとして、京都議定書で定められた温室効果ガスには含まれていない。GWP 16,800、寿命 550年とする報告もある[11]。
1992年までの生産量は100トンに達していなかったが、2007年の生産量は4000トンに上ると見られており、使用量は増加傾向にある[11]。2010年の全世界での生産量は8000トンになると見られている[16][17]。大気中の蓄積量は2006年には4200トン、2008年には5400トンに上ると見られている。2008年時点での温室ガスとしての影響は、二酸化炭素の0.15%にすぎない[18]。
安全性
人体
時間加重平均限界値(TLV-TWA)は10ppmである[19]。NF3は短時間なら皮膚と接触しての危険性は無く、粘膜や眼に与える影響も小さい。肺に吸い込んだ場合には窒素酸化物並みの毒性があり、ひどい場合には血中のヘモグロビンをメトヘモグロビンに変化させてメトヘモグロビン血症[20]となる。
反応性
出典
- ^ Air Products; Physical Properties for Nitrogen Trifluoride
- ^ Sinke, G. C. (1967). “The enthalpy of dissociation of nitrogen trifluoride”. J. Phys. Chem. 71 (2): 359–360. doi:10.1021/j100861a022.
- ^ Inorganic Chemistry, p. 462, - Google ブックス
- ^ a b c NIOSH Pocket Guide to Chemical Hazards 0455
- ^ “Nitrogen trifluoride”. 生活や健康に直接的な危険性がある. アメリカ国立労働安全衛生研究所(NIOSH). 2025年10月20日閲覧。
- ^ H. Reichardt , A. Frenzel and K. Schober (2001). “Environmentally friendly wafer production: NF3 remote microwave plasma for chamber cleaning”. Microelectronic Engineering 56: 73–76. doi:10.1016/S0167-9317(00)00505-0.
- ^ J. Oshinowo, A. Riva, M Pittroff, T. Schwarze and R. Wieland (2009). “Etch performance of Ar/N2/F2 for CVD/ALD chamber clean”. Solid State Technology 52: 20–24.
- ^ Otto Ruff, Joseph Fischer, Fritz Luft (1928). “Das Stickstoff-3-fluorid”. Zeitschrift für anorganische und allgemeine Chemie 172 (1): 417–425. doi:10.1002/zaac.19281720132.
- ^ Philip B. Henderson, Andrew J. Woytek "Fluorine Compounds, Inorganic, Nitrogen" in Kirk‑Othmer Encyclopedia of Chemical Technology, 1994, John Wiley & Sons, NY. doi:10.1002/0471238961.1409201808051404.a01 Article Online Posting Date: December 4, 2000
- ^ Thomas M. Klapötke “Nitrogen–fluorine compounds” Journal of Fluorine Chemistry Volume 127, 2006, pp. 679-687. doi:10.1016/j.jfluchem.2006.03.001
- ^ a b c Prather, M.J.; Hsu, J. (2008). “NF3, the greenhouse gas missing from Kyoto”. Geophysical Research Letters 35: L12810. doi:10.1029/2008GL034542.
- ^ Tsai, W.-T. (2008). “Environmental and health risk analysis of nitrogen trifluoride (NF3), a toxic and potent greenhouse gas”. J. Hazard. Mat. 159: 257. doi:10.1016/j.jhazmat.2008.02.023.
- ^ a b Climate Change 2007: The Physical Sciences Basis, Intergovernmental Panel on Climate Change 2008年7月3日閲覧。
- ^ Robson, J.I.; Gohar, L.K., Hurley, M.D., Shine, K.P. and Wallington, T. (2006). “Revised IR spectrum, radiative efficiency and global warming potential of nitrogen trifluoride”. Geophysical Research Letters 33: L10817. doi:10.1029/2006GL026210.
- ^ Richard Morgan (1 September 2008). “Beyond Carbon: Scientists Worry About Nitrogen’s Effects”. New York Times. 2008年9月7日時点のオリジナルよりアーカイブ. 2008年9月7日閲覧.
- ^ M. Roosevelt (8 July 2008). “A climate threat from flat TVs, microchips”.
- ^ Hoag, Hannah (10 July 2008). “The Missing Greenhouse Gas”. Nature Reports Climate Change. Nature News. doi:10.1038/climate.2008.72.
- ^ MSN産経ニュース 温室効果ガスの三フッ化窒素、従来推定量の4倍以上が大気中に、2008年10月28日、2009年11月7日閲覧
- ^ a b NF3 三フッ化窒素
- ^ Malik, Yogender (2008年7月3日). “Nitrogen trifluoride - Cleaning up in electronic applications”. Gasworld. 2008年7月15日閲覧。
注釈
- ^ この蒸気圧は臨界温度における圧力であり、通常の室温を下回る。
外部リンク
- 三フッ化窒素のページへのリンク



![{\displaystyle {2\,\mathrm {NF} {\vphantom {A}}_{\smash[{t}]{3}}\ {}+{}6\,\mathrm {HCl} {}\mathrel {\longrightarrow } {}6\,\mathrm {HF} \ {}+{}\mathrm {N} {\vphantom {A}}_{\smash[{t}]{2}}\ {}+{}3\,\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0e282746f028bd7110554a2eac7155c2ee8340d0)
![{\displaystyle {2\,\mathrm {NF} {\vphantom {A}}_{\smash[{t}]{3}}\ {}+{}\mathrm {Cu} {}\mathrel {\longrightarrow } {}\mathrm {N} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {F} {\vphantom {A}}_{\smash[{t}]{4}}\ {}+{}\mathrm {CuF} {\vphantom {A}}_{\smash[{t}]{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e42249a1c4c1c2aa0a7efef2b14b96035cb9ff8b)
![{\displaystyle {\mathrm {NF} {\vphantom {A}}_{\smash[{t}]{3}}\ {}+{}\mathrm {F} {\vphantom {A}}_{\smash[{t}]{2}}\ {}+{}\mathrm {SbF} {\vphantom {A}}_{\smash[{t}]{5}}{}\mathrel {\longrightarrow } {}\mathrm {NF} {\vphantom {A}}_{\smash[{t}]{4}}{\vphantom {A}}^{+}\mathrm {SbF} {\vphantom {A}}_{\smash[{t}]{6}}{\vphantom {A}}^{-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a1addb5f134a993a306baca1acab6204a7f138ae)
