アポトーシス【apoptosis】
アポトーシス
アポトーシス
英訳・(英)同義/類義語:apoptosis, Apoptosis
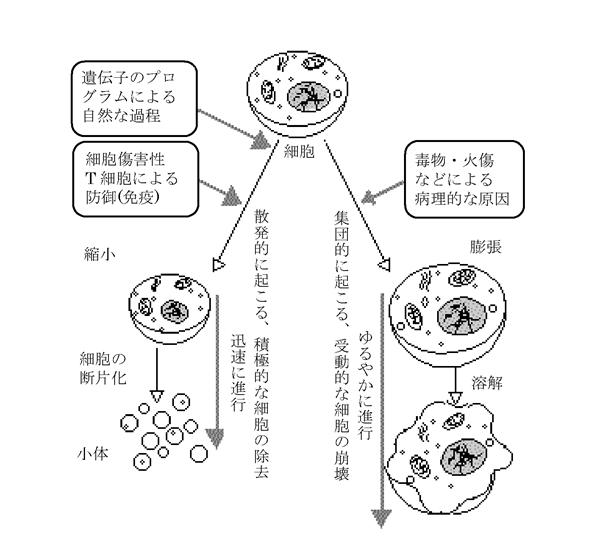
多細胞生物の発生過程で、組織を形成する際に特定の細胞が特定の時期に死ぬ現象。手指の形成や、線虫の発生過程、落葉などが例。細胞が死ぬ機構はアポトーシスによる。
プログラムされた細胞死
英訳・(英)同義/類義語:programmed cell death, apoptosis
多細胞生物の発生過程で、組織を形成する際に特定の細胞が特定の時期に死ぬ現象。手指の形成や、線虫の発生過程、落葉などが例。細胞が死ぬ機構はアポトーシスによる。
| 細胞名や細胞内の構造オルガネラに関連する用語: | トランスゴルジネットワーク ノルアドレナリン作動性ニューロン ヒスタミン神経細胞 プログラムされた細胞死 ヘテロクロマチン ヘルパーT細胞 ベルグマングリア |
アポトーシス
オタマジャクシの発生に伴う尾の消失、手指形成過程における指と指の間の「水かき」の消失、あるいは免疫細胞の成熟の過程における「自己」を認識する免疫細胞の除去などがその例とされる。
この細胞死は遺伝子にプログラムされており、さらにそれがガン関連遺伝子(ガン原遺伝子、ガン抑制遺伝子)と密接な関係があること、免疫系の発達・調節にも深く関与していることが明らかとなってきて、研究が進んでいる。
アポトーシス
アポトーシス
【概要】 プログラムされた細胞死(programmed cell death, cellular suicide)。アポ=離れる+プトーシス=離れる、が語源。オタマジャクシが蛙になるときはシッポが短くなる。これは計画的にシッポの細胞が死んで行くためである。つまり細胞の中には役目が終わったら死ぬようにあらかじめ遺伝子の設計図に書かれている。抗癌剤にさらされた癌細胞が死ぬのもアポトーシス。HIVを作っているCD4細胞が早死にするのもアポトーシスである。一方、例えば火傷で細胞が死ぬのは細胞壊死(えし、necrosis)という。
【詳しく】 細胞の表面にFas抗原と言う物質があらわれ、これに適切な刺激が加わると内部に自殺指令が伝わって行く。HIV感染症では、HIVに感染していない細胞まで巻き込まれて死んで行くのは、HIVがこのメカニズムを誘導しているという説が有力になっている。
《参照》 HIV、 CD4
アポトーシス
アポトーシス
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/11/08 03:41 UTC 版)
| Apoptosis | |
|---|---|

|
|
| MeSH | D017209 |
| 解剖学用語 | |
アポトーシス(英: apoptosis)は、多細胞生物、そして酵母など一部の単細胞真核生物で行われるプログラム細胞死の一形態であり[2]、一連の生化学的イベントによって特徴的な細胞形態の変化と細胞死が引き起こされる[3]。こうした変化には、ブレブの形成、細胞の収縮、核の崩壊、クロマチンの凝縮、DNAの断片化、mRNAの分解が挙げられる。平均的な成人では毎日500億から700億個、8歳から14歳の平均的な小児では毎日200億から300億個の細胞がアポトーシスによって失われている[4]。平均的な成人には13兆個以上の細胞が存在するため[5]:2、およそ0.5%の細胞が毎日アポトーシスによって失われている計算となる。
細胞の急性損傷によって引き起こされる外傷性細胞死の一形態であるネクローシス(壊死)とは対照的に、アポトーシスは高度に調節・制御された過程であり、その存在は生活環を通じて個体に利益をもたらしている。一例として、発生中のヒト胚における手足の指の分離は、遺伝的に決定された形で指間領域の細胞がアポトーシスを起こすことで行われている[6]。ネクローシスとは異なり、アポトーシスではアポトーシス小体と呼ばれる細胞断片が形成され、食細胞によってこうした断片が貪食されて除去されることで、細胞内容物の漏出による周囲の細胞の損傷が防がれている[7]。
アポトーシスはいったん開始されると停止することはできないため、その開始は高度に調節された過程となっている。アポトーシスは内因性経路(intrinsic pathway)と外因性経路(extrinsic pathway)のいずれかを介して開始される。内因性経路はストレスを検知した細胞が自らの死を誘導する経路であるのに対し、外因性経路では他の細胞からのシグナルによって細胞死が誘導される。また、弱い外因性シグナルによって内因性経路が活性化されている場合もある[8]。いずれの経路においても、カスパーゼの活性化によって細胞死が誘導される。カスパーゼは他のタンパク質を分解する酵素(プロテアーゼ)であり、まず誘導型カスパーゼ(initiator caspase)が活性化され、続いて誘導型カスパーゼによって実行型カスパーゼ(executioner/effector caspase)が活性化されることで無差別なタンパク質分解による細胞死が引き起こされる点も両経路に共通している。
アポトーシスは生物学的現象としての重要性に加え、その過程の欠陥が広範囲の疾患と関連していることも示唆されている。過剰なアポトーシスはさまざまな組織の萎縮を引き起こすのに対し、不十分であった場合にはがんのような無制御な細胞増殖が引き起こされる。Fas受容体やカスパーゼといった因子はアポトーシスを促進し、一方Bcl-2ファミリーの一部のメンバーはアポトーシスを阻害する役割を果たしている[9]。
発見と用語
ドイツの科学者カール・フォークトは、1842年にアポトーシスの原理について初めて記載した。そして1885年、解剖学者ヴァルター・フレミングによってプログラム細胞死の過程についてより詳細な記載が行われた。しかしながらその後、このトピックが再び着目されたのは1965年になってからであった。その年、クイーンズランド大学のジョン・カーは電子顕微鏡を用いて組織の研究を行っていた際、外傷による細胞死とアポトーシス過程との区別が可能であることを発見した[10]。この現象について記載した論文の発表後、カーはアバディーン大学のAlastair Currieのもとに招聘され、カー、Currie、そしてCurrieの大学院生であったAndrew Wyllieの三人は1972年に記念碑的論文をBritish Journal of Cancer誌に発表した[11]。カーは当初、この細胞死過程に対してprogrammed cell necrosisという語を用いていたが、この論文において「アポトーシス」(apoptosis)という命名がなされた。三人は、アポトーシスという用語はアバディーン大学のギリシア語の教授であったJames Cormackの提案によるものであるとしている。2000年、カーはアポトーシスの記載に関する業績で、パウル・エールリヒ&ルートヴィヒ・ダルムシュテッター賞をロバート・ホロビッツと共に受賞している[12]。
しかしながらその後も、「アポトーシス」「プログラム細胞死」といった用語は多く引用されるものとはならなかった。細胞死が主要な研究領域へと変貌したのは、細胞死の制御とそのエフェクター機構の構成要素が初めて同定され、細胞死の異常とヒトの疾患、特にがんとの関係が発見されてからである。1988年、濾胞性リンパ腫の原因遺伝子であるBCL2が細胞死を阻害するタンパク質をコードしていることが示されたのである[13]。2002年にはアポトーシスを制御する遺伝子群を同定した業績によって、シドニー・ブレナー、ロバート・ホロビッツ、ジョン・サルストンがノーベル生理学・医学賞を受賞した。遺伝子群の同定は線虫Caenorhabditis elegansを用いて行われ、これらの遺伝子のホモログはヒトでもアポトーシスを調節する機能を果たしていた[14]。

アポトーシスという語は、木から葉が落ちることを意味するギリシア語に由来する[5]:1021。この語は2000年以上前の古代ギリシアですでに医学的意味合いで用いられており、ヒポクラテスはこの語を骨折治療の際の壊疽を指して用いていた[15]。その発音について、アポトーシスとアポプトーシスのどちらが正当なものであるのか(すなわちapoptosisの2番目のpが黙字であるかどうか)については意見が分かれている[16][17][18]。英語では、ギリシア語由来の-pt-子音連結のpは語頭では黙字となるのが一般的であるが(pterodactyl、Ptolemyなど)、helicopter、diptera、lepidopteraなど母音に続く場合には発音される。一方、カー、Wyllie、Currieによるオリジナルの論文[11]では発音に関して次のような脚注があり、黙字とするように記載がある。
We are most grateful to Professor James Cormack of the Department of Greek, University of Aberdeen, for suggesting this term. The word "apoptosis" (ἀπόπτωσις) is used in Greek to describe the "dropping off" or "falling off" of petals from flowers, or leaves from trees. To show the derivation clearly, we propose that the stress should be on the penultimate syllable, the second half of the word being pronounced like "ptosis" (with the "p" silent), which comes from the same root "to fall", and is already used to describe the drooping of the upper eyelid.
アポトーシスの活性化


いったんアポトーシスが開始されると細胞死は不可避であるため、活性化機構は緊密な調節を受けている[3][5]:1029。活性化機構として最もよく理解されている2つの機構は、内因性経路(ミトコンドリア経路)と外因性経路である[5]:1023。内因性経路は細胞がストレスを受けた際に細胞内で生じたシグナルによって活性化され、ミトコンドリア膜間腔からのタンパク質の放出に依存している[5]:1032。外因性経路は細胞外のリガンドが細胞表面の細胞死受容体に結合することで活性化され、細胞死誘導性シグナル伝達複合体(DISC)の形成が引き起こされる[5]:1024。
細胞はストレスへの応答として細胞内のアポトーシスシグナル伝達を開始する[19]。グルココルチコイドの核内受容体への結合[20]、熱[20]、放射線[20]、栄養素の枯渇[20]、ウイルス感染[20]、低酸素[20]、細胞内の遊離脂肪酸濃度の上昇[21]、細胞内のカルシウム濃度の上昇[22][23]、これらは全て損傷細胞内でのアポトーシスシグナルの放出の引き金となる。ポリ(ADP-リボース)ポリメラーゼなど、いくつかの細胞構成要素もアポトーシスの調節を補助している可能性がある[24]。
内因性経路
内因性経路はミトコンドリア経路としても知られている。ミトコンドリアは多細胞生物に必要不可欠であり、ミトコンドリアがなければ細胞は好気呼吸を停止し急速に死に至る。この事実は一部のアポトーシス経路の基盤となっており、アポトーシス促進タンパク質はミトコンドリアを標的としてさまざまな形で影響を及ぼす。例えば、ミトコンドリア膜に孔を形成することでミトコンドリアの膨潤を引き起こしたり、ミトコンドリア膜の透過性を高めてアポトーシスのエフェクターの漏出を引き起こしたりする場合がある[20][25]。また、一酸化窒素はミトコンドリア膜電位の消失を補助し、膜の透過性を高めることでアポトーシスを誘導することを示すエビデンスも蓄積されている[26]。ただし一酸化窒素は他の複数の因子に依存して、アポトーシスの開始と阻害の双方の作用を示す場合がある[27]。
アポトーシス時には、BaxやBakの作用を介してシトクロムcがミトコンドリアから放出される。この放出の機構は完全には解明されていないが、BaxやBakのホモ二量体やヘテロ二量体がミトコンドリア外膜に数多く挿入されることが契機となっているようである[28]。放出されたシトクロムcはApaf-1、ATPと結合し、その後プロカスパーゼ-9を結合することでアポトソームと呼ばれるタンパク質複合体が形成される。アポトソームはプロカスパーゼを切断して活性型であるカスパーゼ-9を形成し、カスパーゼ-9はプロカスパーゼ-3を切断して活性型であるカスパーゼ-3を形成する[29]。
ミトコンドリア膜の透過性の増大後には、SMACと呼ばれるタンパク質も細胞質基質へ放出される。通常、IAPs(inhibitors of apoptosis proteins)と呼ばれるタンパク質群によってカスパーゼの活性は抑制されているが、SMACはIAPsに結合して不活性化し、IAPsによるアポトーシス過程の停止を防ぐことでアポトーシスの進行を可能にする[30]。
外因性経路

哺乳類においてアポトーシス機構を直接開始する経路として、TNF経路とFas経路が提唱されているが、どちらも外因性シグナルに対してTNF受容体ファミリーの受容体が共役する経路である[31]。
TNF経路
TNF-αは主に活性化されたマクロファージで産生されるサイトカインであり、アポトーシスにおける主要な外因性メディエーターである。人体の大部分の細胞には、TNFR1とTNFR2という2種類のTNF-α受容体が存在する。TNF-αがTNFR1に結合することで、TRADD、FADDといった介在タンパク質を介してカスパーゼ活性化につながる経路が開始されることが示されている。通常は、TNF-αシグナルはcIAP1/cIAP2がTNF受容体結合タンパク質TRAF2に結合することで阻害されており、またc-FLIPもカスパーゼ-8の活性化を阻害している[32]。TNF-αとアポトーシスとの関係は、TNF-αの異常産生がヒトのいくつかの疾患、特に自己免疫疾患において重要な役割を果たしていることの説明となる。またTNF受容体ファミリーには、DR4やDR5などのデスレセプター(DR)も含まれている。これらの受容体はTRAILを結合し、アポトーシスを媒介する。アポトーシスはがんの標的治療の主要な機構の1つである[33]。TRAILを模倣した燐光性イリジウム錯体ペプチドハイブリッド(IPH)が設計されており、この分子はがん細胞上のデスレセプターに結合することでアポトーシスを誘導する[34]。
Fas経路
Fas受容体はTNFファミリーの膜貫通タンパク質であり、Fasリガンド(FasL)を結合する[31]。FasとFasLの結合によって細胞死誘導性シグナル伝達複合体(DISC)の形成が引き起こされる。この複合体には、FADDやカスパーゼ-8、カスパーゼ-10が含まれている。Type Iに分類される細胞種では、プロセシングされたカスパーゼ-8がカスパーゼファミリーの他のメンバーを直接活性化し、アポトーシスが実行される。Type IIに分類される細胞種では、Fas-DISCはミトコンドリアからのアポトーシス促進因子の放出の増大によるフィードバックループを介し、カスパーゼ-8の活性化を増幅してアポトーシスを開始する[35]。
両生類モデル
アフリカツメガエルXenopus laevisは、アポトーシス研究に理想的なモデル系である。ヨウ素やチロキシンは両生類の変態時の鰓や尾、鰭の細胞のアポトーシスを刺激し、また水生で草食性のオタマジャクシから陸生で肉食性のカエルへの神経系の変化も刺激する[36][37][38][39]。
アポトーシスの負の調節因子
アポトーシスに対する負の調節は細胞死シグナル伝達経路を阻害するため、腫瘍細胞が細胞死を回避し、薬剤抵抗性を獲得するのを助けることとなる。細胞が生存するか死に至るかは、抗アポトーシスタンパク質(Bcl-2など)とアポトーシス促進タンパク質(Baxなど)の比率によって決定される[40][41]。アポトーシスを負に制御するタンパク質は、抗アポトーシス因子(IAPs、Bcl-2など)もしくは生存促進因子(c-FLIP、BNIP3、FADD、Akt、NF-κBなど)のいずれかに分類される[42]。
アポトーシスの進行
アポトーシスをもたらす経路やシグナルは多く存在するが、実際に細胞死を引き起こす1つの機構へと収束する。こうした刺激を受け取った細胞では、活性化されたカスパーゼによって細胞小器官の組織的分解が行われる。細胞小器官以外にも、mRNAの全般的分解も迅速に行われるが、その機構の十分な特性解析はなされていない[43]。mRNAの分解はアポトーシスにおいて非常に初期の段階で生じる。
アポトーシスを起こした細胞では、一連の形態学的変化が生じる。初期に生じる変化としては次のようなものがある。
- ラメリポディアの退縮とカスパーゼによる細胞骨格の解体[44]、水の排出[45]によって、細胞が収縮し球形化する。
- 細胞質は濃密になり、細胞小器官は密に詰め込まれた状態となる[46]。
- ピクノーシスと呼ばれる過程によってクロマチンは凝縮し、核膜に向かって移動してコンパクトなパッチ状となる[47][48]。
- カリオレキシスと呼ばれる過程によって、核膜は非連続的となり、内部のDNAは断片化される。核は崩壊し、chromatin bodyもしくはnucleosomal unitと呼ばれる数個の塊となる[49]。
アポトーシスは急速に進行し、その産物も迅速に除去されるため、古典的な組織切片を用いたアポトーシスの検出・可視化には困難が伴う。カリオレキシス時にはエンドヌクレアーゼの活性化によって規則的なサイズの短いDNA断片が形成されるため、アガロースゲル電気泳動した際には特徴的なラダー状(はしご状)のパターンとなる[50]。こうしたDNAラダーの形成は、虚血や毒物による細胞死とアポトーシスとの区別に利用される[51]。
細胞の解体

アポトーシスを起こしている細胞を除去する前に、細胞をより小さな部分へ解体する過程が存在する。この過程は次のような3段階を経て進行することが知られている[53]。
- ブレブの形成: 細胞膜がブレブと呼ばれる不定形の出芽を行う。序盤の段階では細胞表面に小さなブレブが形成され、大きく動的挙動を示すブレブへと成長する[53]。ブレブ形成における重要な調節因子の1つがROCK1である[54][55]。
- 膜突起の形成: 一部の細胞種では特定の条件下で、 microtubule spike、apoptopodia、beaded apoptopodiaといったさまざまな種類の細長い突起が形成される[56][57][58]。パネキシン1は、apoptopodiaやbeaded apoptopodiaの形成に関与している重要な膜チャネルである[57]。
- 断片化: 細胞はアポトーシス小体と呼ばれる複数の小胞へ解体され、ファゴサイトーシスが行われる。
死細胞の除去
近傍の食細胞による死細胞の除去は、エフェロサイトーシスと呼ばれている[59]。アポトーシスの最終段階を経て死につつある細胞は、ホスファチジルセリンなど食細胞によって認識される分子を表面に提示する[60]。ホスファチジルセリンは通常は細胞膜の内葉に存在しているが、アポトーシス時にはスクランブラーゼの作用によって細胞外面にも分布するようになる[61]。こうした分子は、マクロファージなど適切な受容体を発現している細胞による食作用の標識となる[62]。食細胞による死につつある細胞の除去は、炎症応答を引き起こすことなく、秩序だった形で行われる[63]。また、アポトーシス時には細胞内のRNAとDNAは互いに分離されて異なるアポトーシス小体へ選別される。こうしたRNAの分離は、核小体の分離によって開始される[64]。
アポトーシス経路のノックアウトの影響
APAF1やFADD、いくつかのカスパーゼなど、アポトーシス経路の因子をノックアウトしたマウスを用いて、各タンパク質の機能の研究が行われている。TNFをノックアウトしたマウスは正常な発生を行い、大きな構造的・形態学的異常は観察されない。しかしながら、ヒツジ赤血球(SRBC)で免疫化した際、これらのマウスでは抗体応答の成熟の欠陥がみられる。すなわちIgMは正常レベルで産生されるものの、特異的IgGを形成することができない[65]。一方でAPAF1をジーントラップ法によってノックアウトした際には、頭蓋顔面の重度の奇形や脳の過成長、指間の水かきの残存といった表現型が観察され、さまざまな刺激に対するアポトーシスの減少がみられる[66]。
アポトーシスとネクローシスの区別

アポトーシスとネクローシスの比較には、無標識ライブセルイメージング、タイムラプス顕微鏡観察、透過型電子顕微鏡観察といった手法が用いられる。また、フローサイトメトリーによる細胞表面マーカー(ホスファチジルセリンの露出と細胞透過性の比較)や細胞内マーカー(DNA断片化など)の解析[67][68]、ウェスタンブロッティングによるカスパーゼの活性化、Bidの切断、シトクロムcの放出の解析といった、さまざまな生化学的手法も用いられる。培養上清を用いたカスパーゼ、HMGB1、サイトケラチン18放出のスクリーニングによって、一次的ネクローシスと二次的ネクローシスを区別することができる。一方で、ネクローシス細胞の明確な細胞表面マーカーや生化学マーカーは特定されておらず、ネガティブマーカーのみが存在するため、ネクローシス細胞の同定にはアポトーシスマーカー(カスパーゼの活性化、シトクロムcの放出、数ヌクレオソーム単位でのDNA断片化)が存在しないことや、細胞死マーカー(ホスファチジルセリンの露出と細胞膜透過化)の速度論的差異が利用される。アポトーシスとネクローシスの区別に用いる技法の選択についてまとめた文献はいくつか発表されている[69][70][71][72]。
疾患との関係



アポトーシス経路の欠陥と疾患
アポトーシスに至る経路には、多くの生化学的構成要素からなる多くの種類が存在しているが、その多くは理解されていない[73]。さまざまなアポトーシス経路の変化によって引き起こされるあらゆる疾患について議論することは現実的ではないが、根底にある概念はおおむね同じであり、経路の正常な機能が破綻し、細胞の正常なアポトーシスの能力が損なわれるということである。アポトーシスの減少と増大のどちらも疾患と関連しており、こうした調節不全はがん、自己免疫疾患や神経変性疾患に重要な役割を果たしている[74]。
アポトーシス経路の欠陥が記載されている例としては、NCI-H460と呼ばれる肺がん細胞株がある[75]。H460細胞株では、アポトーシスを阻害するXIAPが過剰発現している。XIAPはプロセシングされたカスパーゼ-9に結合し、アポトーシスの活性化因子であるシトクロムcの活性を抑制する。そのため、XIAPの過剰発現によってアポトーシス抑制性とアポトーシス促進性のエフェクター間のバランスはアポトーシス抑制側に傾き、細胞死へ差し向けられたはずの損傷細胞も複製を続けることとなる。
がん細胞におけるアポトーシス調節の欠陥は、転写因子制御の段階で生じていることも多い。一例として、転写因子NF-κBを制御する分子の欠陥は転写調節の様式やアポトーシスシグナルへの応答を変化させ、その細胞が属する組織への依存性を低下させる。こうした外部からの生存シグナルに対するある程度の非依存性の獲得によって、がんの転移が可能となっている場合がある[76]。
またDNAが損傷した際には、一連の生化学的因子によってがん抑制タンパク質p53が蓄積する。こうした経路にはI型インターフェロンが関与しており、これらはp53遺伝子の転写を誘導することでp53のタンパク質濃度を高め、そしてがん細胞のアポトーシスを高める[77]。p53は細胞周期をG1期で停止させることで細胞の複製を防ぎ、修復のための時間を稼ぐ。一方で損傷が広範囲にわたり、修復の試みが失敗した場合には、アポトーシスを誘導する[78]。p53やインターフェロンの調節が破綻した場合には、アポトーシスが損なわれ、腫瘍形成に至る可能性がある[79]。
アポトーシスの阻害による疾患
アポトーシスの阻害は、がん、炎症疾患、ウイルス感染症の原因となる場合がある。これらの疾患でみられる細胞の蓄積は細胞増殖の増大のためであると当初は考えられていたが、現在では細胞死の減少もその一因となっていることが知られている。これらの中で最も一般的なのは細胞が過剰増殖する疾患であるがんであり、IAPファミリーのメンバーの過剰発現によって特徴づけられることが多い。こうした過剰発現によって悪性細胞ではアポトーシス誘導に対する異常な応答が生じる。疾患細胞では細胞周期調節遺伝子(p53、Ras、c-Mycなど)が変異または不活性化しており、さらに他の遺伝子(Bcl-2など)も発現が変化している。アポトーシス促進因子の一部はミトコンドリア呼吸に重要であり(シトクロムcなど)[80]、がん細胞におけるアポトーシスの不活性化は解糖系への呼吸代謝のシフトと相関している(この現象はワールブルク効果として知られている)[81]。
HeLa細胞
HeLa細胞では、細胞が産生するタンパク質によってアポトーシスが阻害されている。ヒトパピローマウイルス(HPV)はHeLa細胞の由来となった子宮頸がんの原因となるウイルスであり、HPVに由来するE6、E7タンパク質がHeLa細胞におけるアポトーシス阻害タンパク質となっている[82]。HPV E6は細胞周期を調節しているp53を不活性化し[82]、HPV E7はRbタンパク質に結合して細胞周期制御能力を制限する[83]。これら2種類の阻害タンパク質が、HeLa細胞のアポトーシス発生阻害による不死性の一部を担っている[84]。
治療
細胞死シグナル伝達と関連した疾患による治療の主な手法は、その疾患の原因がアポトーシスの阻害であるか過剰なアポトーシスであるかによって、疾患細胞のアポトーシス感受性を上昇または低下させることとなる。例えば、細胞死の欠陥を伴う疾患にはアポトーシスを回復すること、過剰な細胞死と関連した疾患にはアポトーシスの閾値を高めることを意図した治療が行われる。がんの治療における化学療法や放射線療法は、標的細胞のアポトーシスを誘導することで死滅させるものである[85]。トラスツズマブやゲフィチニブ、イマチニブといった薬剤は、上流の成長・生存シグナルを遮断することで細胞周期の進行を停止させ、アポトーシスの活性化を引き起こす。他にもアポトーシスの刺激には、デスレセプターのリガンド(TNFやTRAILなど)の量を増やす、抗アポトーシス性のBcl-2経路に対抗する、IAPを阻害するSMAC模倣薬を導入するといった戦略がとられる[40]。細胞死シグナル伝達経路のさまざまな地点でアポトーシスを刺激または阻害する多くの手法が用いられている[86]。
過剰なアポトーシスによる疾患
細胞死制御の喪失(その結果生じる過剰なアポトーシス)は、神経変性疾患、血液疾患、組織損傷の原因となる。アルツハイマー病[87]やパーキンソン病[88]などの神経変性疾患では、ミトコンドリア呼吸に依存している神経細胞のアポトーシスが生じる(inverse Warburg effectと呼ばれる[80][89])。さらに、神経変性疾患とがんとの間には疫学的なinverse comorbidity(一方の疾患に罹患している場合には他方のリスクが低下する)がみられる[90]。
治療
治療は特定のカスパーゼの遮断を意図して行われる。Aktは2つの経路を介して細胞生存を促進することが知られている。まずAktはBadをリン酸化し、Badが14-3-3タンパク質と相互作用するようになった結果、Badと結合していたBcl-2などアポトーシス抑制性のタンパク質が解離し、細胞生存が促進される。またAktはIKKαも活性化し、NF-κBの活性化と細胞生存をもたらす。活性型NF-κBはBcl-2など抗アポトーシス因子の発現を誘導し、アポトーシスを阻害する。一方で、NF-κBは用いる刺激や細胞種に依存して、抗アポトーシス作用とアポトーシス促進作用の双方の役割を果たすことが知られている[91]。
HIV感染症の進行
HIV感染のAIDSへの進行は主に、骨髄による細胞供給が追い付かないほどにCD4+ヘルパーT細胞が急速に枯渇することが原因となっており、その結果免疫系は機能不全となる。ヘルパーT細胞が枯渇する機構の1つがアポトーシスであり、次に挙げる一連の機構によって引き起こされている[92]。
- HIV由来の酵素が抗アポトーシスタンパク質Bcl-2を不活性化する。これ自体で細胞死が直接引き起こされるわけではないが、細胞は適切なシグナルを受け取った際にアポトーシスが開始されるよう、プライミングされた状態となる。並行して、これらの酵素はプロカスパーゼ-8を活性化し、アポトーシスのミトコンドリア経路が直接活性化される。
- HIVは、Fasを介したアポトーシス経路を促進する細胞タンパク質の濃度を高めている可能性がある。
- HIV由来のタンパク質は、細胞膜上に存在するCD4糖タンパク質マーカーの量を減少させる。
- 細胞外液へ放出されたウイルス粒子やウイルスタンパク質が、近傍のバイスタンダーT細胞のアポトーシスを誘導する。
- HIVは細胞がアポトーシスを起こしていることを標識する分子の産生を低下させることでウイルスの複製のための時間を稼ぎ、周辺組織へのアポトーシス促進因子やビリオンの放出を継続する。
- HIVが感染したCD4+T細胞は、細胞傷害性T細胞からも細胞死シグナルを受け取る可能性がある。
細胞はウイルス感染の直接的帰結として死に至る可能性もある。一例として尿細管上皮細胞では、HIV-1の遺伝子発現によって細胞周期はG2/M期で停止し、アポトーシスが誘導される[93]。HIV感染からAIDSへの進行は即座に起こるわけではなく、また必ずしも急速に進行するわけでもない。HIVのCD4+T細胞に対する細胞傷害活性によって患者のCD4+細胞数が血液1 μlあたり200個未満となった際に、AIDSへと分類される[94]。
L-Heptanoylphosphatidyl Inositol Pentakisphosphate(L-Hippo)と呼ばれる合成化合物はHIVのPr55Gagタンパク質に強力に結合し、ウイルスの出芽を抑制することができる。そしてウイルスの出芽の抑制によって、HIVを細胞内に捕捉した状態でアポトーシスを行わせることができる。このアプローチは患者への応用はまだなされていないものの、将来的にはHIV感染症からの完全な回復が達成される可能性がある[95]。
ウイルス感染
ウイルスが感染した細胞では、さまざまな機構を介してアポトーシスが誘導される。
- 受容体への結合
- プロテインキナーゼRの活性化
- p53との相互作用
- 感染細胞表面のMHCタンパク質によるウイルスタンパク質の提示。免疫系の細胞(NK細胞や細胞傷害性T細胞)によって人遺棄され、感染細胞のアポトーシスが誘導される[96]。
犬ジステンパーウイルス(CDV)は、感染したイヌの中枢神経系やリンパ組織のアポトーシスを引き起こすことがin vivo、in vitroで示されている[97]。CDVによって引き起こされるアポトーシスは典型的には外因性経路を介したものであり、カスパーゼが活性化されて細胞機能が破綻し、最終的に細胞死に至る[98]。正常細胞では、CDVはまず誘導型のカスパーゼ-8を活性化し、続いて実行型のカスパーゼ-3が活性化される。一方HeLa細胞では、CDVによって誘発されるアポトーシスにはカスパーゼ-8は関与しない。このようなカスパーゼカスケードの変化は、CDVが内因性経路を介してアポトーシスを誘導していることを示唆している。こうしたケースでは、実行型カスパーゼはカスパーゼカスケードではなく、ウイルス感染によって引き起こされた内因性刺激によって活性化される[98]。
オロプーシェウイルス(OROV)は、ブニヤウイルス綱に属するウイルスである。ブニヤウイルスによって引き起こされるアポトーシスの研究は、新生ハムスターの腎細胞や新生マウスの脳においてラクロスウイルスによるアポトーシスの誘導が観察された1996年に始まった[99]。OROVは吸血性のヌカカCulicoides paraensisを介してヒトの間を伝播するウイルスである[100]。人獣共通感染症の原因となるアルボウイルスであり、オロプーシェ熱と呼ばれる急な発熱を特徴とする疾患を引き起こす[101]。オロプーシェウイルスはHeLa細胞などの培養細胞にも悪影響を及ぼし、細胞では感染直後に変性が開始される[99]。ゲル電気泳動により、OROVはHeLa細胞においてDNA断片化を引き起こすことが観察されている[99]。また、ミトコンドリア膜からはシトクロムcが放出されており、内因性経路を介してアポトーシスが活性化されていることが示されている[102][99]。
ウイルス感染に伴うアポトーシス誘導に対抗するため、多くのウイルスはアポトーシスを阻害するタンパク質を有している[103]。いくつかのウイルスにはBcl-2のホモログが存在する。これらのホモログは、BAXやBAKなど、アポトーシスの活性化に必要不可欠なタンパク質を阻害する。ウイルスのBcl-2タンパク質の例としては、EBウイルスのBHRF1タンパク質や、アデノウイルスのE1B-19Kタンパク質が挙げられる[104]。また一部のウイルスは、カスパーゼ活性を阻害するタンパク質を発現する。例としては、牛痘ウイルスのCrmAタンパク質がある。TNFやFasの作用を遮断するものもあり、一例としてミクソーマウイルスのM-T2タンパク質はTNFに結合し、TNF受容体への結合と応答の誘導を妨げる[105]。さらに、多くのウイルスはp53阻害タンパク質を発現しており、これらはp53に結合してその転写活性化能を阻害する。その結果、p53はアポトーシス促進タンパク質の発現を誘導することができなくなる。アデノウイルスのE1B-55Kタンパク質やB型肝炎ウイルスのHBxタンパク質は、こうした機能を果たすタンパク質の例である[106]。
特に感染の後期段階では、ウイルスはアポトーシスに干渉しない場合がある。ウイルスは死滅しつつある細胞の表面からくびり切られるアポトーシス小体内へ輸送され、食細胞に貪食されることで宿主の応答の開始を逃れる。このようにしてウイルスの拡散が促進される[105]。
植物
植物におけるプログラム細胞死は、多くの点で動物のアポトーシスとの分子的類似性がみられるものの、差異も存在する。特筆すべき点としては、植物には細胞壁が存在すること、そして死細胞の破片を除去する免疫系が存在しないことが挙げられる。さらに、植物には分解やアポトーシス小体の除去といった過程に必要不可欠な食細胞も存在しない。死滅しつつある細胞は免疫応答を誘導する代わりに、自身を分解する物質を合成して液胞内に貯蔵し、細胞死とともに液胞が破裂することで分解をもたらす[107]。この全過程が「アポトーシス」という名称を使用することができるほど、動物における過程と十分に類似しているかどうか、すなわちより一般的な「プログラム細胞死」ではなく「アポトーシス」という名称を使用するのが適切であるのかどうかは明確ではない[108][109]。
カスパーゼ非依存的なアポトーシス
カスパーゼの特性解析が行われたことでカスパーゼ阻害剤の開発が可能となり、こうした阻害剤は特定の細胞過程に活性型カスパーゼが関与しているかどうかを明らかにするために用いられている。その結果、細胞は形態学的にはアポトーシスとの類似性を示すものの、カスパーゼの活性化を伴わない細胞死を行う場合があることが発見されている[110]。この現象は、ミトコンドリアからのアポトーシス誘導因子(AIF)の放出、核移行と関連しており[111]、放出にはカルパインによる切断が関与している[112]。
出典
- ^ Janicke, Birgit (2012), CIL_43705, Homo sapiens, prostate cancer, doi:10.7295/W9CIL43705 2025年11月7日閲覧。
- ^ Green D (2011). Means to an End: Apoptosis and other Cell Death Mechanisms. Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press. ISBN 978-0-87969-888-1. オリジナルの2020-07-26時点におけるアーカイブ。 2020年5月25日閲覧。
- ^ a b Böhm I, Schild H (2003). “Apoptosis: the complex scenario for a silent cell death”. Mol Imaging Biol 5 (1): 2–14. doi:10.1016/S1536-1632(03)00024-6. PMID 14499155.
- ^ Karam JA (2009). Apoptosis in Carcinogenesis and Chemotherapy. Netherlands: Springer. ISBN 978-1-4020-9597-9
- ^ a b c d e f Molecular biology of the cell (6th ed ed.). New York: Garland science, Taylor and Francis group. (2015). ISBN 978-0-8153-4432-2
- ^ Elmore S (June 2007). “Apoptosis: a review of programmed cell death”. Toxicol Pathol 35 (4): 495–516. doi:10.1080/01926230701320337. PMC 2117903. PMID 17562483.
- ^ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2008). “Chapter 18 Apoptosis: Programmed Cell Death Eliminates Unwanted Cells”. Molecular Biology of the Cell (textbook) (5th ed.). Garland Science. p. 1115. ISBN 978-0-8153-4105-5
- ^ Raychaudhuri S (August 2010). “A minimal model of signaling network elucidates cell-to-cell stochastic variability in apoptosis”. PLOS ONE 5 (8). arXiv:1009.2294. Bibcode: 2010PLoSO...511930R. doi:10.1371/journal.pone.0011930. PMC 2920308. PMID 20711445.
- ^ Elmore S (June 2007). “Apoptosis: A Review of Programmed Cell Death”. Toxicologic Pathology 35 (4): 495–516. doi:10.1080/01926230701320337. PMC 2117903. PMID 17562483.
- ^ Kerr JF (October 1965). “A histochemical study of hypertrophy and ischaemic injury of rat liver with special reference to changes in lysosomes”. The Journal of Pathology and Bacteriology 90 (2): 419–435. doi:10.1002/path.1700900210. PMID 5849603.
- ^ a b Kerr JF, Wyllie AH, Currie AR (August 1972). “Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics”. British Journal of Cancer 26 (4): 239–257. doi:10.1038/bjc.1972.33. PMC 2008650. PMID 4561027.
- ^ O'Rourke MG, Ellem KA (2000). “John Kerr and apoptosis”. The Medical Journal of Australia 173 (11–12): 616–617. doi:10.5694/j.1326-5377.2000.tb139362.x. PMID 11379508.
- ^ Vaux DL, Cory S, Adams JM (September 1988). “Bcl-2 gene promotes haemopoietic cell survival and cooperates with c-myc to immortalize pre-B cells”. Nature 335 (6189): 440–2. Bibcode: 1988Natur.335..440V. doi:10.1038/335440a0. PMID 3262202.
- ^ “The Nobel Prize in Physiology or Medicine 2002” (英語). NobelPrize.org. 2025年1月13日閲覧。
- ^ André, Nicolas (2003-04-12). “Hippocrates of Cos and apoptosis”. Lancet (London, England) 361 (9365): 1306. doi:10.1016/S0140-6736(03)13017-6. ISSN 0140-6736. PMID 12699996.
- ^ “The American Heritage Dictionary entry: apoptosis”. ahdictionary.com. Houghton Mifflin Harcourt Publishing Company (2020年). 2021年7月26日時点のオリジナルよりアーカイブ。2021年7月26日閲覧。
- ^ Apoptosis Interest Group (1999年). “About apoptosis”. 2006年12月28日時点のオリジナルよりアーカイブ。2006年12月15日閲覧。
- ^ “Definition of apoptosis”. www.webster.com. 2007年7月3日時点のオリジナルよりアーカイブ。2007年8月11日閲覧。
- ^ Nirmala, J. Grace; Lopus, Manu (2020). “Cell death mechanisms in eukaryotes”. Cell Biology and Toxicology 36 (2): 145–164. doi:10.1007/s10565-019-09496-2. ISSN 1573-6822. PMID 31820165.
- ^ a b c d e f g Cotran RS, Kumar C (1998). Robbins Pathologic Basis of Disease. Philadelphia: W.B Saunders Company. ISBN 978-0-7216-7335-6
- ^ Hardy S, El-Assaad W, Przybytkowski E, Joly E, Prentki M, Langelier Y (August 2003). “Saturated fatty acid-induced apoptosis in MDA-MB-231 breast cancer cells. A role for cardiolipin”. The Journal of Biological Chemistry 278 (34): 31861–31870. doi:10.1074/jbc.m300190200. PMID 12805375.
- ^ Mattson MP, Chan SL (December 2003). “Calcium orchestrates apoptosis”. Nature Cell Biology 5 (12): 1041–1043. doi:10.1038/ncb1203-1041. PMID 14647298. オリジナルの2019-11-21時点におけるアーカイブ。 2018年5月18日閲覧。.
- ^ Uğuz AC, Naziroğlu M, Espino J, Bejarano I, González D, Rodríguez AB, Pariente JA (December 2009). “Selenium modulates oxidative stress-induced cell apoptosis in human myeloid HL-60 cells through regulation of calcium release and caspase-3 and -9 activities”. The Journal of Membrane Biology 232 (1–3): 15–23. doi:10.1007/s00232-009-9212-2. PMID 19898892.
- ^ Chiarugi A, Moskowitz MA (July 2002). “Cell biology. PARP-1--a perpetrator of apoptotic cell death?”. Science 297 (5579): 200–201. doi:10.1126/science.1074592. PMID 12114611.
- ^ Gonzalez D, Bejarano I, Barriga C, Rodriguez AB, Pariente JA (2010). “Oxidative Stress-Induced Caspases are Regulated in Human Myeloid HL-60 Cells by Calcium Signal”. Current Signal Transduction Therapy 5 (2): 181–186. doi:10.2174/157436210791112172.
- ^ Brüne B (August 2003). “Nitric oxide: NO apoptosis or turning it ON?”. Cell Death and Differentiation 10 (8): 864–869. doi:10.1038/sj.cdd.4401261. PMID 12867993.
- ^ Brüne B, von Knethen A, Sandau KB (October 1999). “Nitric oxide (NO): an effector of apoptosis”. Cell Death and Differentiation 6 (10): 969–975. doi:10.1038/sj.cdd.4400582. PMID 10556974.
- ^ Uren RT, Iyer S, Kluck RM (August 2017). “Pore formation by dimeric Bak and Bax: an unusual pore?”. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences 372 (1726). doi:10.1098/rstb.2016.0218. PMC 5483520. PMID 28630157.
- ^ Li, Peng; Nijhawan, Deepak; Budihardjo, Imawati; Srinivasula, Srinivasa M; Ahmad, Manzoor; Alnemri, Emad S; Wang, Xiaodong (November 1997). “Cytochrome c and dATP-Dependent Formation of Apaf-1/Caspase-9 Complex Initiates an Apoptotic Protease Cascade” (English). Cell 91 (4): 479–489. doi:10.1016/S0092-8674(00)80434-1. ISSN 0092-8674. PMID 9390557.
- ^ Fesik SW, Shi Y (November 2001). “Structural biology. Controlling the caspases”. Science 294 (5546): 1477–1478. doi:10.1126/science.1062236. PMID 11711663.
- ^ a b Wajant H (May 2002). “The Fas signaling pathway: more than a paradigm”. Science 296 (5573): 1635–1636. Bibcode: 2002Sci...296.1635W. doi:10.1126/science.1071553. PMID 12040174.
- ^ Chen G, Goeddel DV (May 2002). “TNF-R1 signaling: a beautiful pathway”. Science 296 (5573): 1634–1635. Bibcode: 2002Sci...296.1634C. doi:10.1126/science.1071924. PMID 12040173.
- ^ Gerl R, Vaux DL (February 2005). “Apoptosis in the development and treatment of cancer”. Carcinogenesis 26 (2): 263–270. doi:10.1093/carcin/bgh283. PMID 15375012.
- ^ Masum AA, Yokoi K, Hisamatsu Y, Naito K, Shashni B, Aoki S (September 2018). “Design and synthesis of a luminescent iridium complex-peptide hybrid (IPH) that detects cancer cells and induces their apoptosis”. Bioorganic & Medicinal Chemistry 26 (17): 4804–4816. doi:10.1016/j.bmc.2018.08.016. PMID 30177492.
- ^ Wajant H (2007). “Connection Map for Fas Signaling Pathway”. Science's STKE 2007 (380): tr1. doi:10.1126/stke.3802007tr1. オリジナルの2009-05-03時点におけるアーカイブ。 2004年1月1日閲覧。.
- ^ Jewhurst K, Levin M, McLaughlin KA (2014). “Optogenetic Control of Apoptosis in Targeted Tissues of Xenopus laevis Embryos”. Journal of Cell Death 7: 25–31. doi:10.4137/JCD.S18368. PMC 4213186. PMID 25374461.
- ^ Venturi S (2011). “Evolutionary Significance of Iodine”. Current Chemical Biology 5 (3): 155–62. doi:10.2174/187231311796765012.
- ^ Venturi, Sebastiano (2014). “Iodine, PUFAs and Iodolipids in Health and Disease: An Evolutionary Perspective”. Human Evolution 29 (1–3): 185–205. ISSN 0393-9375.
- ^ Tamura K, Takayama S, Ishii T, Mawaribuchi S, Takamatsu N, Ito M (June 2015). “Apoptosis and differentiation of Xenopus tail-derived myoblasts by thyroid hormone”. Journal of Molecular Endocrinology 54 (3): 185–192. doi:10.1530/JME-14-0327. PMID 25791374.
- ^ a b Jan R, Chaudhry GE (June 2019). “Understanding Apoptosis and Apoptotic Pathways Targeted Cancer Therapeutics”. Advanced Pharmaceutical Bulletin 9 (2): 205–218. doi:10.15171/apb.2019.024. PMC 6664112. PMID 31380246.
- ^ Kale J, Osterlund EJ, Andrews DW (January 2018). “BCL-2 family proteins: changing partners in the dance towards death”. Cell Death and Differentiation 25 (1): 65–80. doi:10.1038/cdd.2017.186. PMC 5729540. PMID 29149100.
- ^ Razaghi A, Heimann K, Schaeffer PM, Gibson SB (February 2018). “Negative regulators of cell death pathways in cancer: perspective on biomarkers and targeted therapies”. Apoptosis 23 (2): 93–112. doi:10.1007/s10495-018-1440-4. PMID 29322476.
- ^ Thomas MP, Liu X, Whangbo J, McCrossan G, Sanborn KB, Basar E, Walch M, Lieberman J (May 2015). “Apoptosis Triggers Specific, Rapid, and Global mRNA Decay with 3' Uridylated Intermediates Degraded by DIS3L2”. Cell Reports 11 (7): 1079–1089. doi:10.1016/j.celrep.2015.04.026. PMC 4862650. PMID 25959823.
- ^ Böhm I (May 2003). “Disruption of the cytoskeleton after apoptosis induction with autoantibodies”. Autoimmunity 36 (3): 183–189. doi:10.1080/0891693031000105617. PMID 12911286.
- ^ Zgorzelska, A (31 October 2025). “Changes of nanoviscosity during TRAIL-induced apoptosis of HeLa cells”. Cell Reports Physical Sciences. doi:10.1016/j.xcrp.2025.102927.
- ^ Elmore, Susan (2007). “Apoptosis: A Review of Programmed Cell Death”. Toxicologic Pathology 35 (4): 495–516. doi:10.1080/01926230701320337. PMC 2117903. PMID 17562483.
- ^ Susin SA, Daugas E, Ravagnan L, Samejima K, Zamzami N, Loeffler M, Costantini P, Ferri KF, Irinopoulou T, Prévost MC, Brothers G, Mak TW, Penninger J, Earnshaw WC, Kroemer G (August 2000). “Two distinct pathways leading to nuclear apoptosis”. The Journal of Experimental Medicine 192 (4): 571–580. doi:10.1084/jem.192.4.571. PMC 2193229. PMID 10952727.
- ^ Kihlmark M, Imreh G, Hallberg E (October 2001). “Sequential degradation of proteins from the nuclear envelope during apoptosis”. Journal of Cell Science 114 (Pt 20): 3643–3653. doi:10.1242/jcs.114.20.3643. PMID 11707516.
- ^ Nagata S (April 2000). “Apoptotic DNA fragmentation”. Experimental Cell Research 256 (1): 12–18. doi:10.1006/excr.2000.4834. PMID 10739646.
- ^ Gong J, Traganos F, Darzynkiewicz Z (May 1994). “A selective procedure for DNA extraction from apoptotic cells applicable for gel electrophoresis and flow cytometry”. Analytical Biochemistry 218 (2): 314–319. doi:10.1006/abio.1994.1184. PMID 8074286.
- ^ Iwata M, Myerson D, Torok-Storb B, Zager RA (December 1994). “An evaluation of renal tubular DNA laddering in response to oxygen deprivation and oxidant injury”. Journal of the American Society of Nephrology 5 (6): 1307–1313. doi:10.1681/ASN.V561307. PMID 7893995.
- ^ Smith A, Parkes MA, Atkin-Smith GK, Tixeira R, Poon IK (2017). “Cell disassembly during apoptosis” (英語). WikiJournal of Medicine 4 (1). doi:10.15347/wjm/2017.008.
- ^ a b Tixeira R, Caruso S, Paone S, Baxter AA, Atkin-Smith GK, Hulett MD, Poon IK (March 2017). “Defining the morphologic features and products of cell disassembly during apoptosis”. Apoptosis 22 (3): 475–477. doi:10.1007/s10495-017-1345-7. PMID 28102458.
- ^ Coleman ML, Sahai EA, Yeo M, Bosch M, Dewar A, Olson MF (April 2001). “Membrane blebbing during apoptosis results from caspase-mediated activation of ROCK I”. Nature Cell Biology 3 (4): 339–345. doi:10.1038/35070009. PMID 11283606.
- ^ Sebbagh M, Renvoizé C, Hamelin J, Riché N, Bertoglio J, Bréard J (April 2001). “Caspase-3-mediated cleavage of ROCK I induces MLC phosphorylation and apoptotic membrane blebbing”. Nature Cell Biology 3 (4): 346–352. doi:10.1038/35070019. PMID 11283607.
- ^ Moss DK, Betin VM, Malesinski SD, Lane JD (June 2006). “A novel role for microtubules in apoptotic chromatin dynamics and cellular fragmentation”. Journal of Cell Science 119 (Pt 11): 2362–2374. doi:10.1242/jcs.02959. PMC 1592606. PMID 16723742.
- ^ a b Poon IK, Chiu YH, Armstrong AJ, Kinchen JM, Juncadella IJ, Bayliss DA, Ravichandran KS (March 2014). “Unexpected link between an antibiotic, pannexin channels and apoptosis”. Nature 507 (7492): 329–334. Bibcode: 2014Natur.507..329P. doi:10.1038/nature13147. PMC 4078991. PMID 24646995.
- ^ Atkin-Smith GK, Tixeira R, Paone S, Mathivanan S, Collins C, Liem M, Goodall KJ, Ravichandran KS, Hulett MD, Poon IK (June 2015). “A novel mechanism of generating extracellular vesicles during apoptosis via a beads-on-a-string membrane structure”. Nature Communications 6. Bibcode: 2015NatCo...6.7439A. doi:10.1038/ncomms8439. PMC 4490561. PMID 26074490.
- ^ Vandivier RW, Henson PM, Douglas IS (June 2006). “Burying the dead: the impact of failed apoptotic cell removal (efferocytosis) on chronic inflammatory lung disease”. Chest 129 (6): 1673–1682. doi:10.1378/chest.129.6.1673. PMID 16778289.
- ^ Li MO, Sarkisian MR, Mehal WZ, Rakic P, Flavell RA (November 2003). “Phosphatidylserine receptor is required for clearance of apoptotic cells”. Science 302 (5650): 1560–1563. Bibcode: 2003Sci...302.1560O. doi:10.1126/science.1087621. PMID 14645847.
- ^ Wang X, Wu YC, Fadok VA, Lee MC, Gengyo-Ando K, Cheng LC, Ledwich D, Hsu PK, Chen JY, Chou BK, Henson P, Mitani S, Xue D (November 2003). “Cell corpse engulfment mediated by C. elegans phosphatidylserine receptor through CED-5 and CED-12”. Science 302 (5650): 1563–1566. Bibcode: 2003Sci...302.1563W. doi:10.1126/science.1087641. PMID 14645848. オリジナルの2021-04-14時点におけるアーカイブ。 2017年2月26日閲覧。.
- ^ Savill J, Gregory C, Haslett C (November 2003). “Cell biology. Eat me or die”. Science 302 (5650): 1516–1517. doi:10.1126/science.1092533. hdl:1842/448. PMID 14645835.
- ^ Krysko DV, Vandenabeele P (2009-01-14). Phagocytosis of dying cells: from molecular mechanisms to human diseases. Springer. doi:10.1007/978-1-4020-9293-0. ISBN 978-1-4020-9292-3. オリジナルの2022-04-30時点におけるアーカイブ。 2017年8月28日閲覧。
- ^ Halicka HD, Bedner E, Darzynkiewicz Z (November 2000). “Segregation of RNA and separate packaging of DNA and RNA in apoptotic bodies during apoptosis”. Experimental Cell Research 260 (2): 248–256. doi:10.1006/excr.2000.5027. PMID 11035919.
- ^ Marino MW, Dunn A, Grail D, Inglese M, Noguchi Y, Richards E, Jungbluth A, Wada H, Moore M, Williamson B, Basu S, Old LJ (July 1997). “Characterization of tumor necrosis factor-deficient mice”. Proceedings of the National Academy of Sciences of the United States of America 94 (15): 8093–8098. Bibcode: 1997PNAS...94.8093M. doi:10.1073/pnas.94.15.8093. PMC 21562. PMID 9223320.
- ^ Cecconi, F.; Alvarez-Bolado, G.; Meyer, B. I.; Roth, K. A.; Gruss, P. (1998-09-18). “Apaf1 (CED-4 homolog) regulates programmed cell death in mammalian development”. Cell 94 (6): 727–737. doi:10.1016/s0092-8674(00)81732-8. ISSN 0092-8674. PMID 9753320.
- ^ Lozano GM, Bejarano I, Espino J, González D, Ortiz A, García JF, Rodríguez AB, Pariente JA (2009). “Density gradient capacitation is the most suitable method to improve fertilization and to reduce DNA fragmentation positive spermatozoa of infertile men”. Anatolian Journal of Obstetrics & Gynecology 3 (1): 1–7. オリジナルの2022-04-30時点におけるアーカイブ。 2016年3月8日閲覧。.
- ^ Darzynkiewicz Z, Juan G, Li X, Gorczyca W, Murakami T, Traganos F (January 1997). “Cytometry in cell necrobiology: analysis of apoptosis and accidental cell death (necrosis)”. Cytometry 27 (1): 1–20. doi:10.1002/(sici)1097-0320(19970101)27:1<1::aid-cyto2>3.0.co;2-l. PMID 9000580.
- ^ Krysko DV, Vanden Berghe T, Parthoens E, D'Herde K, Vandenabeele P (2008). “Chapter 16 Methods for Distinguishing Apoptotic from Necrotic Cells and Measuring Their Clearance”. Programmed Cell Death, General Principles for Studying Cell Death, Part A. Methods in Enzymology. 442. pp. 307–41. doi:10.1016/S0076-6879(08)01416-X. ISBN 978-0-12-374312-1. PMID 18662577
- ^ Krysko DV, Vanden Berghe T, D'Herde K, Vandenabeele P (March 2008). “Apoptosis and necrosis: detection, discrimination and phagocytosis”. Methods 44 (3): 205–221. doi:10.1016/j.ymeth.2007.12.001. PMID 18314051.
- ^ Vanden Berghe T, Grootjans S, Goossens V, Dondelinger Y, Krysko DV, Takahashi N, Vandenabeele P (June 2013). “Determination of apoptotic and necrotic cell death in vitro and in vivo”. Methods 61 (2): 117–129. doi:10.1016/j.ymeth.2013.02.011. PMID 23473780. オリジナルの2019-11-05時点におけるアーカイブ。 2019年11月5日閲覧。.
- ^ Wlodkowic D, Telford W, Skommer J, Darzynkiewicz Z (2011). “Apoptosis and beyond: cytometry in studies of programmed cell death”. Recent Advances in Cytometry, Part B – Advances in Applications. Methods in Cell Biology. 103. pp. 55–98. doi:10.1016/B978-0-12-385493-3.00004-8. ISBN 978-0-12-385493-3. PMC 3263828. PMID 21722800
- ^ Thompson CB (March 1995). “Apoptosis in the pathogenesis and treatment of disease”. Science 267 (5203): 1456–1462. Bibcode: 1995Sci...267.1456T. doi:10.1126/science.7878464. PMID 7878464.
- ^ Hassan, Mohamed; Watari, Hidemichi; AbuAlmaaty, Amr; Ohba, Shingo; Sakuragi, Noriaki (2014). “Apoptosis and molecular targeting therapy in cancer”. BioMed Research International 2014: 1–23. doi:10.1155/2014/150845. PMC 3384434. PMID 25013758.
- ^ Yang L, Mashima T, Sato S, Mochizuki M, Sakamoto H, Yamori T, Oh-Hara T, Tsuruo T (February 2003). “Predominant suppression of apoptosome by inhibitor of apoptosis protein in non-small cell lung cancer H460 cells: therapeutic effect of a novel polyarginine-conjugated Smac peptide”. Cancer Research 63 (4): 831–837. PMID 12591734. オリジナルの2012-12-20時点におけるアーカイブ。 2008年9月4日閲覧。.
- ^ Vlahopoulos SA (August 2017). “Aberrant control of NF-κB in cancer permits transcriptional and phenotypic plasticity, to curtail dependence on host tissue: molecular mode”. Cancer Biology & Medicine 14 (3): 254–270. doi:10.20892/j.issn.2095-3941.2017.0029. PMC 5570602. PMID 28884042.
- ^ Takaoka A, Hayakawa S, Yanai H, Stoiber D, Negishi H, Kikuchi H, Sasaki S, Imai K, Shibue T, Honda K, Taniguchi T (July 2003). “Integration of interferon-alpha/beta signalling to p53 responses in tumour suppression and antiviral defence”. Nature 424 (6948): 516–523. Bibcode: 2003Natur.424..516T. doi:10.1038/nature01850. PMID 12872134.
- ^ Bernstein C, Bernstein H, Payne CM, Garewal H (June 2002). “DNA repair/pro-apoptotic dual-role proteins in five major DNA repair pathways: fail-safe protection against carcinogenesis”. Mutation Research 511 (2): 145–178. Bibcode: 2002MRRMR.511..145B. doi:10.1016/S1383-5742(02)00009-1. PMID 12052432.
- ^ Soussi, Thierry (2000). “The p53 Tumor Suppressor Gene: From Molecular Biology to Clinical Investigation” (英語). Annals of the New York Academy of Sciences 910 (1): 121–139. Bibcode: 2000NYASA.910..121S. doi:10.1111/j.1749-6632.2000.tb06705.x. ISSN 1749-6632. PMID 10911910.
- ^ a b Kaczanowski S (May 2016). “Apoptosis: its origin, history, maintenance and the medical implications for cancer and aging”. Physical Biology 13 (3). Bibcode: 2016PhBio..13c1001K. doi:10.1088/1478-3975/13/3/031001. PMID 27172135. オリジナルの2019-04-28時点におけるアーカイブ。 2019年12月26日閲覧。.
- ^ Warburg O (February 1956). “On the origin of cancer cells”. Science 123 (3191): 309–314. Bibcode: 1956Sci...123..309W. doi:10.1126/science.123.3191.309. PMID 13298683.
- ^ a b Liu HC, Chen GG, Vlantis AC, Tse GM, Chan AT, van Hasselt CA (March 2008). “Inhibition of apoptosis in human laryngeal cancer cells by E6 and E7 oncoproteins of human papillomavirus 16”. Journal of Cellular Biochemistry 103 (4): 1125–1143. doi:10.1002/jcb.21490. PMID 17668439.
- ^ Niu XY, Peng ZL, Duan WQ, Wang H, Wang P (2006). “Inhibition of HPV 16 E6 oncogene expression by RNA interference in vitro and in vivo”. International Journal of Gynecological Cancer 16 (2): 743–751. doi:10.1111/j.1525-1438.2006.00384.x. PMID 16681755.
- ^ Liu Y, McKalip A, Herman B (May 2000). “Human papillomavirus type 16 E6 and HPV-16 E6/E7 sensitize human keratinocytes to apoptosis induced by chemotherapeutic agents: roles of p53 and caspase activation”. Journal of Cellular Biochemistry 78 (2): 334–349. doi:10.1002/(sici)1097-4644(20000801)78:2<334::aid-jcb15>3.3.co;2-6. PMID 10842327.
- ^ Lowe, Scott W.; Lin, Albert W. (2000-03-01). “Apoptosis in cancer”. Carcinogenesis 21 (3): 485–495. doi:10.1093/carcin/21.3.485. PMID 10688869 2025年1月22日閲覧。.
- ^ Boehm I (June 2006). “Apoptosis in physiological and pathological skin: implications for therapy”. Current Molecular Medicine 6 (4): 375–394. doi:10.2174/156652406777435390. PMID 16900661.
- ^ LaFerla FM, Tinkle BT, Bieberich CJ, Haudenschild CC, Jay G (January 1995). “The Alzheimer's A beta peptide induces neurodegeneration and apoptotic cell death in transgenic mice”. Nature Genetics 9 (1): 21–30. doi:10.1038/ng0195-21. PMID 7704018.
- ^ Mochizuki H, Goto K, Mori H, Mizuno Y (May 1996). “Histochemical detection of apoptosis in Parkinson's disease”. Journal of the Neurological Sciences 137 (2): 120–123. doi:10.1016/0022-510X(95)00336-Z. PMID 8782165.
- ^ Demetrius LA, Magistretti PJ, Pellerin L (2014). “Alzheimer's disease: the amyloid hypothesis and the Inverse Warburg effect”. Frontiers in Physiology 5: 522. doi:10.3389/fphys.2014.00522. PMC 4294122. PMID 25642192.
- ^ Musicco M, Adorni F, Di Santo S, Prinelli F, Pettenati C, Caltagirone C, Palmer K, Russo A (July 2013). “Inverse occurrence of cancer and Alzheimer disease: a population-based incidence study”. Neurology 81 (4): 322–328. doi:10.1212/WNL.0b013e31829c5ec1. PMID 23843468.
- ^ Farhana L, Dawson MI, Fontana JA (June 2005). “Apoptosis induction by a novel retinoid-related molecule requires nuclear factor-kappaB activation”. Cancer Research 65 (11): 4909–4917. doi:10.1158/0008-5472.CAN-04-4124. PMID 15930313.
- ^ Alimonti JB, Ball TB, Fowke KR (July 2003). “Mechanisms of CD4+ T lymphocyte cell death in human immunodeficiency virus infection and AIDS”. The Journal of General Virology 84 (Pt 7): 1649–1661. doi:10.1099/vir.0.19110-0. PMID 12810858.
- ^ Vashistha H, Husain M, Kumar D, Yadav A, Arora S, Singhal PC (2008). “HIV-1 expression induces tubular cell G2/M arrest and apoptosis”. Renal Failure 30 (6): 655–664. doi:10.1080/08860220802134672. PMID 18661417.
- ^ Indiana University Health. “AIDS Defining Criteria | Riley”. IU Health. 2013年5月26日時点のオリジナルよりアーカイブ。2013年1月20日閲覧。
- ^ Tateishi H, Monde K, Anraku K, Koga R, Hayashi Y, Ciftci HI, DeMirci H, Higashi T, Motoyama K, Arima H, Otsuka M, Fujita M (August 2017). “A clue to unprecedented strategy to HIV eradication: "Lock-in and apoptosis"”. Scientific Reports 7 (1). Bibcode: 2017NatSR...7.8957T. doi:10.1038/s41598-017-09129-w. PMC 5567282. PMID 28827668.
- ^ Everett H, McFadden G (April 1999). “Apoptosis: an innate immune response to virus infection”. Trends in Microbiology 7 (4): 160–165. doi:10.1016/S0966-842X(99)01487-0. PMID 10217831.
- ^ Nishi T, Tsukiyama-Kohara K, Togashi K, Kohriyama N, Kai C (November 2004). “Involvement of apoptosis in syncytial cell death induced by canine distemper virus”. Comparative Immunology, Microbiology and Infectious Diseases 27 (6): 445–455. doi:10.1016/j.cimid.2004.01.007. PMID 15325517.
- ^ a b Del Puerto HL, Martins AS, Milsted A, Souza-Fagundes EM, Braz GF, Hissa B, Andrade LO, Alves F, Rajão DS, Leite RC, Vasconcelos AC (June 2011). “Canine distemper virus induces apoptosis in cervical tumor derived cell lines”. Virology Journal 8 (1). doi:10.1186/1743-422X-8-334. PMC 3141686. PMID 21718481.
- ^ a b c d Acrani GO, Gomes R, Proença-Módena JL, da Silva AF, Carminati PO, Silva ML, Santos RI, Arruda E (April 2010). “Apoptosis induced by Oropouche virus infection in HeLa cells is dependent on virus protein expression”. Virus Research 149 (1): 56–63. doi:10.1016/j.virusres.2009.12.013. PMID 20080135.
- ^ Azevedo RS, Nunes MR, Chiang JO, Bensabath G, Vasconcelos HB, Pinto AY, Martins LC, Monteiro HA, Rodrigues SG, Vasconcelos PF (June 2007). “Reemergence of Oropouche fever, northern Brazil”. Emerging Infectious Diseases 13 (6): 912–915. doi:10.3201/eid1306.061114. PMC 2792853. PMID 17553235.
- ^ Santos RI, Rodrigues AH, Silva ML, Mortara RA, Rossi MA, Jamur MC, Oliver C, Arruda E (December 2008). “Oropouche virus entry into HeLa cells involves clathrin and requires endosomal acidification”. Virus Research 138 (1–2): 139–143. doi:10.1016/j.virusres.2008.08.016. PMC 7114418. PMID 18840482.
- ^ Indran IR, Tufo G, Pervaiz S, Brenner C (June 2011). “Recent advances in apoptosis, mitochondria and drug resistance in cancer cells”. Biochimica et Biophysica Acta (BBA) - Bioenergetics 1807 (6): 735–745. doi:10.1016/j.bbabio.2011.03.010. PMID 21453675.
- ^ Teodoro JG, Branton PE (March 1997). “Regulation of apoptosis by viral gene products”. Journal of Virology 71 (3): 1739–1746. doi:10.1128/jvi.71.3.1739-1746.1997. PMC 191242. PMID 9032302.
- ^ Polster BM, Pevsner J, Hardwick JM (March 2004). “Viral Bcl-2 homologs and their role in virus replication and associated diseases”. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research 1644 (2–3): 211–227. doi:10.1016/j.bbamcr.2003.11.001. PMID 14996505.
- ^ a b Hay S, Kannourakis G (July 2002). “A time to kill: viral manipulation of the cell death program”. The Journal of General Virology 83 (Pt 7): 1547–1564. doi:10.1099/0022-1317-83-7-1547. PMID 12075073.
- ^ Wang XW, Gibson MK, Vermeulen W, Yeh H, Forrester K, Stürzbecher HW, Hoeijmakers JH, Harris CC (December 1995). “Abrogation of p53-induced apoptosis by the hepatitis B virus X gene”. Cancer Research 55 (24): 6012–6016. PMID 8521383.
- ^ van Doorn WG, Beers EP, Dangl JL, Franklin-Tong VE, Gallois P, Hara-Nishimura I, Jones AM, Kawai-Yamada M, Lam E, Mundy J, Mur LA, Petersen M, Smertenko A, Taliansky M, Van Breusegem F, Wolpert T, Woltering E, Zhivotovsky B, Bozhkov PV (August 2011). “Morphological classification of plant cell deaths”. Cell Death and Differentiation 18 (8): 1241–1246. doi:10.1038/cdd.2011.36. PMC 3172093. PMID 21494263.
- ^ Collazo C, Chacón O, Borrás O (2006). “Programmed cell death in plants resembles apoptosis of animals”. Biotecnología Aplicada 23: 1–10. オリジナルの2009-03-03時点におけるアーカイブ。.
- ^ Dickman M, Williams B, Li Y, de Figueiredo P, Wolpert T (October 2017). “Reassessing apoptosis in plants”. Nature Plants 3 (10): 773–779. Bibcode: 2017NatPl...3..773D. doi:10.1038/s41477-017-0020-x. PMID 28947814.
- ^ Xiang J, Chao DT, Korsmeyer SJ (December 1996). “BAX-induced cell death may not require interleukin 1 beta-converting enzyme-like proteases”. Proceedings of the National Academy of Sciences of the United States of America 93 (25): 14559–14563. Bibcode: 1996PNAS...9314559X. doi:10.1073/pnas.93.25.14559. PMC 26172. PMID 8962091.
- ^ Susin SA, Lorenzo HK, Zamzami N, Marzo I, Snow BE, Brothers GM, Mangion J, Jacotot E, Costantini P, Loeffler M, Larochette N, Goodlett DR, Aebersold R, Siderovski DP, Penninger JM, Kroemer G (February 1999). “Molecular characterization of mitochondrial apoptosis-inducing factor”. Nature 397 (6718): 441–446. Bibcode: 1999Natur.397..441S. doi:10.1038/17135. PMID 9989411.
- ^ Polster, Brian M.; Basañez, Gorka; Etxebarria, Aitor; Hardwick, J. Marie; Nicholls, David G. (2005-02-25). “Calpain I induces cleavage and release of apoptosis-inducing factor from isolated mitochondria”. The Journal of Biological Chemistry 280 (8): 6447–6454. doi:10.1074/jbc.M413269200. ISSN 0021-9258. PMID 15590628.
関連項目
外部リンク
アポトーシス
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2022/05/17 14:57 UTC 版)
本作に登場するコンピュータウィルス「アポトーシス」は、続編の『Twelve Y. O.』にて「アポトーシスII」として改良されて再登場する。
※この「アポトーシス」の解説は、「川の深さは」の解説の一部です。
「アポトーシス」を含む「川の深さは」の記事については、「川の深さは」の概要を参照ください。
「アポトーシス」の例文・使い方・用例・文例
- アポトーシスのページへのリンク