ナイトロジェンマスタード
| 分子式: | C5H11Cl2N |
| その他の名称: | ムスタゲン、メクロルエタミン、Mustagen、Mechlorethamine、N,N-Bis(2-chloroethyl)-N-methylamine、2-Chloro-N-(2-chloroethyl)-N-methylethanamine、クロルエタジンNFN、Chlorethazine NFN、クロルエタジン、Chlorethazine、Nitrogen mustard、ナイトロジェンマスタード、クロルメチン、Chlormethine、MBA、2-Chloro-N-(2-chloroethyl)-N-methylethan-1-amine、N,N-Bis(2-chloroethyl)methylamine、メクロレタミン、窒素マスタード、Mustin、ムスチン、Mustine、HN2、Methylbis(2-chloroethyl)amine、Bis(2-chloroethyl)methylamine |
| 体系名: | N-(2-クロロエチル)-N-メチル-2-クロロエタンアミン、ビス(2-クロロエチル)メチルアミン、N,N-ビス(2-クロロエチル)メタンアミン、N,N-ビス(2-クロロエチル)メチルアミン、2-クロロ-N-(2-クロロエチル)-N-メチルエタン-1-アミン、2-クロロ-N-(2-クロロエチル)-N-メチルエタンアミン、N,N-ビス(2-クロロエチル)-N-メチルアミン、メチルビス(2-クロロエチル)アミン |
ナイトロジェンマスタード
(窒素マスタード から転送)
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/04/19 15:50 UTC 版)
ナイトロジェンマスタード(Nitrogen mustard、窒素マスタードとも呼ぶ) は化学兵器のびらん剤の一つ。化合物としてはアミン類であり[1]、第一次世界大戦で使われたマスタードガスの硫黄原子を窒素に置き換えた分子構造である。
また、細胞毒性に着目して使用された最初の抗がん剤であり、白血病や悪性リンパ腫の治療薬として使われていた。クロロエチル基がDNAをアルキル化することによって核酸の合成を妨げ抗腫瘍効果を現す[2]。
歴史
マスタードガスは、
- 硫黄由来の臭気を持つ。
- 水に溶けにくく、油に溶けやすい
- 毒性が強い
以上の3点から、化学兵器としては取り扱いにくい物であった。そのため、第一次世界大戦後、各国でマスタードガスの改良が試みられ、アメリカとドイツでほぼ同時に完成。これがHN-2である(後記)。合成法に関しては1935年、チェコスロバキアの科学者ウラジミール・プレローグとヘンドリック・ステフェンにより報告された。
HN-2は常温で液体で、水に溶けないが、塩酸と反応して水溶性の塩(沸点109~111℃)となる。マスタードガスほどではないが毒性は強く、ラットへの静脈注射によるLD50は1.1mg/kg。暴露経路は、皮膚や呼吸器、眼球などからの吸入であるが、遅効性であり、暴露後数時間を経てから皮膚のただれや水疱の発生等の症状が生じる[2][3]。第二次世界大戦中には実戦使用されていないが、ドイツ軍はHN-3を2,000トン製造していたとされる[1]。
1943年12月2日、イタリアの連合国側の重要補給基地であるバーリ港にドイツ軍は爆撃を仕掛け、輸送船・タンカーを始めとする艦船16隻が沈没した。その中のアメリカ海軍リバティー型輸送船「ジョン・E・ハーヴェイ号」には大量のマスタードガスが積まれており、漏れたマスタードガスがタンカーから出た油に混じったため、救助された連合軍兵士たちは大量に被曝。
翌朝、兵士たちは目や皮膚を侵され、重篤な患者は血圧の低下、末梢血管の血流の急激な減少などを経て白血球値が大幅に減少。結果、被害を受けた617人中83名が死亡したが、一日あたりの死者の数を見ると、被害後2日目、3日目に最初のピークを迎え(イペリットによる直接の死者)、8日、9日後に再度ピーク(白血球の大幅な減少による感染症)を迎えた。
アメリカ陸軍はこの事件および化学兵器研究チームの報告から、マスタードガスおよびナイトロジェンマスタードがX線同様に突然変異を引き起こす可能性が高いと考え、当時はX線照射療法しかなかった悪性リンパ腫の治療が試みられた。マウスで成果が確かめられた後、1946年の8月には末期癌患者に対して新たに開発されたHN-3の塩酸塩が使用された。10日間の注射で、腫瘍は二日目から縮小し始めて二週間で消滅。副作用で障害を受けた骨髄も数週間後には回復したが、結局再発死亡した。
1949年、東京帝国大学医学部薬学科教授・石館守三と東北帝国大学医学部病理学教授・吉田富三は、ナイトロジェンマスタードの毒性を弱めるためにナイトロジェンマスタードの塩酸塩を炭酸水素ナトリウム水溶液に溶かし、過酸化水素で酸化することによりナイトロジェンマスタードN-オキシド(商品名:ナイトロミン)を合成したが、その毒性はナイトロジェンマスタードの半分以下であった。ナイトロミンの塩酸塩は、日本では吉富製薬(当時。現在の田辺三菱製薬)により抗悪性腫瘍剤として販売された。[4](2014年現在ナイトロミンは日本では販売されていない。)
その後、ドイツで同じくナイトロジェンマスタード誘導体のシクロホスファミドが開発され、ナイトロミンは市場を奪われることになった。さらに、ナイトロジェンマスタード誘導体としてクロラムブシル、メルファラン、ウラシルマスタードなどが開発されて現在に至る。
このように、ナイトロジェンマスタードはアルキル化剤の第一号として抗がん剤の歴史の一ページを開いたのである。
種類
マスタードガス分子内の硫黄原子(S)を窒素原子(N)に置き換えた骨格を持ち、以下の3種類が知られている。
- N,N-ビス(2-クロロエチル)エチルアミン(HN-1)
- 化学式:CH3CH2N(CH2CH2Cl)2
- CAS登録番号:538-07-8
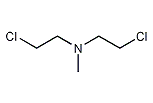
- N,N-ビス(2-クロロエチル)メチルアミン(HN-2、メクロレタミン)
- 化学式:CH3N(CH2CH2Cl)2
- 融点 14.45℃
- CAS登録番号:51-75-2
- トリス(2-クロロエチル)アミン(HN-3)
- 化学式:(CH2CH2Cl)3N
- CAS登録番号:555-77-1
-
HN-1 の構造式
-
HN-2 の構造式
-
HN-3 の構造式
出典
- ^ a b Robin Black (2016年). “Development, Historical Use and Properties of Chemical Warfare Agents”. The Royal Society of Chemistry. 2017年5月31日閲覧。
- ^ a b 国立医薬品食品衛生研究所 安全情報部 びらん剤
- ^ 危険物化学剤の種類と特徴
- ^ http://www.sasaki-foundation.jp/foundation/keisai/pu_gan_02jul.html
- 窒素マスタードのページへのリンク