硫酸
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2024/02/10 06:27 UTC 版)
用途

硫酸を原料(実際には発煙硫酸と塩化水素から製造したクロロスルホン酸を反応に用いる)に合成される直鎖アルキルベンゼンスルホン酸ナトリウム(RC6H4SO3Na)および高級アルコールの硫酸モノエステルのナトリウム塩であるラウリル硫酸ナトリウム(CH3(CH2)11OSO3Na)は合成洗剤、シャンプーおよび歯磨き粉などの界面活性剤として用いられる。多数のスルホ基(-SO3H)を有する高分子は陽イオン交換樹脂として、イオン交換膜および水の精製などに用いられる。酸触媒としてはニトロ化合物製造の反応助剤として重要な役割を持つ。
また安価な強酸であることから希硫酸は、デンプンの糖化による水飴の製造、臭素およびヨウ素の製造、紡績、金属の電解精錬用の電解液としても用いられる。鉛蓄電池の電解液としては濃度約33%(d=1.24 g cm−3)の希硫酸が用いられ、放電に伴い濃度は低下する。
肥料としては硫安、過リン酸石灰の製造原料として大量に消費される。紙を濃硫酸で処理した半透明の薄い紙は硫酸紙と呼ばれ、羊皮紙の代用として用いられる[21]。
イオン
硫酸イオン
硫酸イオン(りゅうさんいおん、sulfate, SO2−
4)は主に硫酸およびその化合物の電離、分解などによって生成する2価の陰イオンで硫酸塩結晶中にも存在する、硫黄化合物である。
正四面体型構造で、硫酸ヒドラジン(N₂H₆SO₄)結晶中のS-O結合距離は149pmであり、単結合と二重結合の中間的な長さに相当する。このS-O間の共有結合に関しては、当初はs、p軌道に加えd軌道も混じった混成であるという意見や(これはd軌道のエネルギーの高さから、SF6の場合と同様早期に否定的な意見が出ている)、酸素原子上の非共有電子対のバックドネーション的な効果が提唱されていたものの、実験と理論の両面からの検討により単結合と捉えるのが妥当であることが判明した[22]。なお単なる単結合より結合距離が短い点に関しては、酸素原子と硫黄原子上にそれぞれ−1.5と+4価程度の電荷が存在すること、共有結合そのものも分極が強く電荷にかなりの偏りがあることにより、S-O間に共有結合に加えクーロン力(イオン結合的な力)が働いているためである。
硫酸は強い酸化剤となるため、イオン化傾向の低い金属などにも作用し、硫酸イオンを含む多くの金属の化合物を作る。硫酸イオンより酸素原子が1つ少ないイオン (SO2−
3) は亜硫酸イオンと呼ばれる。
金属イオンに対する配位結合は弱いほうであるが、コバルト(III)イオンなどに対してはスルファト錯体(sulfato)を形成する。
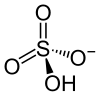
硫酸水素イオン 硫酸水素イオン(りゅうさんすいそいおん、hydrogensulfate, HSO4−)は硫酸の一段階目の電離により生成し、また硫酸水素塩の結晶中に存在する1価の陰イオンであり、やや歪んだ四面体型構造で、水素原子が結合したO-S結合距離がやや長い。
希硫酸中には硫酸イオンは寧ろ低濃度でしか存在せず陰イオンの多くは硫酸水素イオンとして存在し、硫酸濃度を10−2 mol dm−3程度以下に希釈をして初めて硫酸イオンが主な化学種となる。 たとえばラマンスペクトルによる結果では3.5 mol kg−1 (3.07 mol dm−3)の希硫酸ではHSO4−が2.06 mol dm−3、SO42−が1.01 mol dm−3である[23]。
塩
硫酸は製造が安価にできる不揮発性の強酸であるために、種々の硫酸塩が工業製品として製造されている。
硫酸塩は硫酸イオンを含むイオン結晶であり、多くのものは水溶性であるが、アルカリ土類金属塩(CaSO4, SrSO4, BaSO4, RaSO4)、鉛塩(PbSO4)および銀塩(Ag2SO4) は難溶性であり、バリウム塩およびラジウム塩は特に水への溶解度が極めて低い。本来硫酸イオンは無色透明であるが遷移金属イオンを含むものは様々な色を呈する。(記事 硫酸塩も参照のこと)
- 硫酸亜鉛 (ZnSO4) – 七水和物は皓礬(こうばん)
- 硫酸アルミニウム (Al2(SO4)3)
- 硫酸アルミニウムカリウム (AlK(SO4)2·12H2O) – 最も一般的なミョウバン
- 硫酸アンモニウム ((NH4)2SO4) – 硫安、肥料として用いられる
- 硫酸カリウム (K2SO4) – 肥料
- 硫酸カルシウム (CaSO4) – 石膏の主成分
- 硫酸銀 (Ag2SO4)
- 硫酸クロムカリウム (CrK(SO4)2·12H2O) – クロムミョウバン
- 硫酸タリウム (Tl2SO4) – 殺鼠剤の有効成分
- 硫酸鉄(II) (FeSO4) – 七水和物は緑礬
- 硫酸鉄(III) (Fe2(SO4)3)
- 硫酸銅(I) (Cu2SO4)
- 硫酸銅(II) (CuSO4) – 五水和物は胆礬
- 硫酸ナトリウム (Na2SO4) – 芒硝(ぼうしょう)
- 硫酸鉛 (PbSO4) – 鉛蓄電池の電極
- 硫酸ニッケル (NiSO4)
- 硫酸バリウム (BaSO4) – 造影剤、用紙の白さを増す用途(写真印画紙のバライタ紙、酸性紙)など。
- 硫酸マグネシウム (MgSO4) – 瀉利塩(しゃりえん、Epsom salt)
硫酸水素塩
硫酸水素塩(りゅうさんすいそえん、hydrogensulfate)は硫酸水素イオン(HSO4−)を含むイオン結晶で、水素塩(酸性塩)の一種であり、広義には硫酸塩に含まれる。重硫酸塩(じゅうりゅうさんえん、bisulfate)、酸性硫酸塩(さんせいりゅうさんえん、acid sulfate)などと呼ばれることもあるが正式名称ではない。多くのものが吸湿性で水に易溶であり、水溶液は硫酸水素イオンの電離のため酸性を示す。
硫酸水素塩はアルカリ金属塩(MIHSO4)が硫酸塩と硫酸の等モル混合水溶液の濃縮により得られ比較的安定であり、加熱により脱水し二硫酸塩(MI2S2O7)となる。難溶性塩の酸性融解の融剤あるいは白金坩堝などの洗浄に用いられる。
アルカリ土類金属塩、鉛塩(MII(HSO4)2)などは硫酸塩を熱濃硫酸に溶解し冷却すると得られるが、吸湿により硫酸塩と硫酸に分解しやすい[21]。
また硫酸一水和物H2SO4·H2Oは濃硫酸に計算量の水を加えて冷却すると結晶として得られ、融点は8.5℃であり固体(H3O+·HSO4−)はオキソニウムイオンと硫酸水素イオンからなるイオン結晶である。
- 硫酸水素アンモニウム (NH4HSO4)
- 硫酸水素カリウム (KHSO4)
- 硫酸水素カルシウム (Ca(HSO4)2)
- 硫酸水素ナトリウム (NaHSO4)
- 硫酸水素ニトロシル (NOHSO4) – ニトロソ化試薬
硫酸塩鉱物
鉱物学において、硫酸塩からなる鉱物を硫酸塩鉱物(りゅうさんえんこうぶつ、sulfate mineral)という。硫化鉱物の酸化および熱水からの析出などにより生成し、以下のようなものがある。
- 明礬石, Alunite(KAl3(SO4)2(OH)6)
- マラー石, Mallardite(MnSO4·7H2O)
- 緑礬, Melanterite(FeSO4·7H2O)
- 赤礬, Bieberite(CoSO4·7H2O)
- 亜鉛緑礬, Zinc-melanterite((Zn,Mn,Mg,Fe)SO4·7H2O)
- 胆礬, Chalcanthite(CuSO4·5H2O)
- 石膏, Gypsum(CaSO4·2H2O)
- 硬石膏, Anhydrite(CaSO4)
- 天青石, Celestite(SrSO4)
- 重晶石, Barite(BaSO4)
- 硫酸鉛鉱, Anglesite(PbSO4)
- 北投石, Hokutolite((Ba,Pb)SO4)
- ^ a b c 厚生労働省モデルSDS
- ^ a b “Sulfuric acid safety data sheet”. arkema-inc.com. 2012年6月17日時点のオリジナルよりアーカイブ。8/29/2021閲覧。 “Clear to turbid oily odorless liquid, colorless to slightly yellow.”
- ^ “Sulfuric acid – uses”. dynamicscience.com.au. 2013年5月9日時点のオリジナルよりアーカイブ。8/29/2021閲覧。
- ^ “BASF Chemical Emergency Medical Guidelines – Sulfuric acid (H2SO4)”. BASF Chemical Company (2012年). 2019年6月14日時点のオリジナルよりアーカイブ。2014年12月18日閲覧。
- ^ Chenier, Philip J. (1987). Survey of Industrial Chemistry. New York: John Wiley & Sons. pp. 45–57. ISBN 978-0-471-01077-7
- ^ Hermann Müller "Sulfuric Acid and Sulfur Trioxide" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. 2000 doi:10.1002/14356007.a25_635
- ^ “Sulfuric acid”. 2019年2月21日閲覧。
- ^ “Sulphuric acid drain cleaner”. herchem.com. 2013年10月29日時点のオリジナルよりアーカイブ。2013年6月7日閲覧。
- ^ a b D.D. Wagman, W.H. Evans, V.B. Parker, R.H. Schumm, I. Halow, S.M. Bailey, K.L. Churney, R.I. Nuttal, K.L. Churney and R.I. Nuttal, The NBS tables of chemical thermodynamics properties, J. Phys. Chem. Ref. Data 11 Suppl. 2 (1982)
- ^ M.J.Jorgentson, D.R. Hatter, J. Am. Chem. Soc., vol.85,878(1963).
- ^ a b シャロー 『溶液内の化学反応と平衡』 藤永太一郎、佐藤昌憲訳、丸善、1975年
- ^ a b c 田中元治 『基礎化学選書8 酸と塩基』 裳華房、1971年
- ^ a b F.A. コットン, G. ウィルキンソン著, 中原 勝儼訳 『コットン・ウィルキンソン無機化学』 培風館、1987年, 原書:F. ALBERT COTTON and GEOFFREY WILKINSON, Cotton and Wilkinson ADVANCED INORGANIC CHEMISTRY A COMPREHENSIVE TEXT Fourth Edition, INTERSCIENCE, 1980.
- ^ Greenwood, Norman N.; Earnshaw, A. (1997). Chemistry of the Elements, 2nd Edition, Oxford: Butterworth-Heinemann.
- ^ 湯川泰秀訳 『ストライトウィーザー有機化学解説(1)(第4版)』 広川書店、1995年
- ^ 国立天文台編『理科年表 平成25年』 p.388、丸善
- ^ 『造幣局百年史(資料編)』 大蔵省造幣局、1971年
- ^ 触媒懇談会ニュース No. 62 触媒学会シニア懇談会 January 1, 2014。2017年12月3日 閲覧 (PDF)
- ^ 三井造船技報 No. 200(2010-6)。2017年12月3日 閲覧 (PDF)
- ^ 経済産業省生産動態統計年報 化学工業統計編
- ^ a b 化学大辞典編集委員会 『化学大辞典』 共立出版、1993年
- ^ M. S. Schmøkel, S. Cenedese, J. Overgaard, M. R. V. Jørgensen, Y.-S. Chen, C. Gatti, D. Stalke and B. B. Iversen, Inorg. Chem., 51, 8607 (2012).
- ^ E. B. Robertson and H. B. Dunford, J. Am. Chem. Soc., 86, 5080 (1964).
硫酸と同じ種類の言葉
- >> 「硫酸」を含む用語の索引
- 硫酸のページへのリンク





