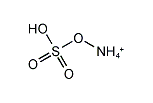
アンモニウムスルファート
硫酸水素アンモニウム
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/07/07 01:37 UTC 版)
| 硫酸水素アンモニウム | |
|---|---|
 |
 |
 |
|
 |
|
|
Ammonium hydrogen sulfate |
|
| 識別情報 | |
|
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.029.332 |
|
PubChem CID
|
|
| RTECS number |
|
| UNII | |
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| 特性 | |
| 化学式 | (NH4)HSO4 |
| モル質量 | 115.11 g/mol |
| 外観 | 白色の固体 |
| 密度 | 1.78 g/cm3 |
| 融点 | 147 °C, 420 K, 297 °F |
| 水への溶解度 | 溶けやすい |
| その他溶媒への溶解度 | メタノールに溶ける アセトンに溶けない |
| 危険性 | |
| NFPA 704(ファイア・ダイアモンド) | |
| 安全データシート (SDS) | External MSDS |
| 関連する物質 | |
| その他の 陰イオン |
チオ硫酸アンモニウム 亜硫酸アンモニウム 硫酸アンモニウム 過硫酸アンモニウム |
| その他の 陽イオン |
硫酸水素ナトリウム 硫酸水素カリウム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
硫酸水素アンモニウム(りゅうさんすいそアンモニウム、ammonium hydrogen sulfate)は硫酸のアンモニウム塩のひとつである。化学式 (NH4)HSO4 で表され、重硫酸アンモニウム(じゅうりゅうさんアンモニウム、ammonium bisulfate)、酸性硫酸アンモニウム(さんせいりゅうさんアンモニウム、acid ammonium sulfate)とも呼ばれる。水に溶ける。アルコール、アセトン、ピリジンに不溶[1]。
硫酸アンモニウムを空気中で357℃に加熱すると粗品ができ、純品は硫酸アンモニウムの硫酸溶液から結晶化させることにより得られる。無色で斜方晶系の結晶。融点146.9℃、沸点490℃。水への溶解度は20℃で100g/100gである。アルカリに微溶、アセトンに不溶。
加熱すると窒素、二酸化硫黄、水を放って亜硫酸水素アンモニウムになる。
かつてこの低温水溶液を電気分解することにより過酸化水素を製造する電解法が行われていたが、アントラキノン法に現在は完全に移行したため工業的に使われることはあまりない。
類似化合物に硫酸水素三アンモニウム (NH4)3H(SO4)2、硫酸三水素アンモニウム (NH4)H3(SO4)2 がある。
出典
- ^ Merck Index, 13th ISBN 0911910-13-1
関連項目
- 硫酸アンモニウム (NH4)2SO4
固有名詞の分類
- 硫酸水素アンモニウムのページへのリンク