あしょうさん‐アンモニウム〔アセウサン‐〕【亜硝酸アンモニウム】
亜硝酸アンモニウム
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/04/27 10:15 UTC 版)
| 亜硝酸アンモニウム | |
|---|---|
 |
|
 |
|
| 識別情報 | |
| CAS登録番号 | 13446-48-5  |
| PubChem | 26004 |
| ChemSpider | 24223  |
| UNII | 71ZQG69956 |
| EC番号 | 236-598-7 |
|
|
|
|
| 特性 | |
| 化学式 | [NH 4]NO 2 |
| モル質量 | 64.04 g/mol |
| 外観 | 無色または淡黄色 |
| 密度 | 1.69 g/cm3 |
| 融点 | 分解 |
| 水への溶解度 | 118.3 g / 100mL |
| 爆発性 | |
| 衝撃感度 | 低い |
| 摩擦感度 | 低い |
| 危険性 | |
| GHSピクトグラム |   |
| GHSシグナルワード | 危険 |
| 主な危険性 | 爆発物 |
| NFPA 704 | |
| 引火点 | 不燃 |
| 発火点 | 不燃 |
| 関連する物質 | |
| その他の陰イオン | 硝酸アンモニウム |
| その他の陽イオン | 硝酸ナトリウム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
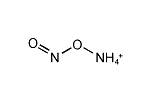
亜硝酸アンモニウム(あしょうさんアンモニウム、[NH
4]NO
2))は、亜硝酸のアンモニウム塩である。非常に不安定であり、室温においても水と窒素に分解するため、通常は単離された形では使用されない。
調製
亜硝酸アンモニウムは大気中で自然に形成されるほか、等量の二酸化窒素と一酸化窒素をアンモニア水に吸収させることによって調製できる[1]。
また、オゾンや過酸化水素によるアンモニアの酸化、あるいは以下の沈殿反応でも合成可能である。バリウムや鉛の亜硝酸塩と硫酸アンモニウム、亜硝酸銀と塩化アンモニウム、過塩素酸アンモニウムと亜硝酸カリウム等を用い、沈殿物を濾過し、濾液を濃縮すると、水溶性の無色結晶を形成する。
物理特性および化学特性
亜硝酸アンモニウムは60 - 70 °Cで爆発の危険があり[1]、濃縮水溶液の状態では乾燥させた結晶の状態よりも速く分解する。室温においても、徐々に水と窒素に分解する。
[NH
4]NO
2 → N
2 + 2 H
2O
亜硝酸アンモニウムは、加熱または酸の存在下で水と窒素に分解する[2]。亜硝酸アンモニウム溶液は高いpHと低い温度で安定し、pHが7.0を下回ると爆発するおそれがある。アンモニア水を加えることで、安全なpHを維持することができる。
出典
- ^ a b Thomas Scott; Mary Eagleson (1994). Concise encyclopedia chemistry. Walter de Gruyter. p. 66. ISBN 3-11-011451-8
- ^ “VIAS Encyclopedia: Ammonium Nitrite”. 2023年2月11日閲覧。
亜硝酸アンモニウムと同じ種類の言葉
- 亜硝酸アンモニウムのページへのリンク