カリウム
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2024/02/12 02:54 UTC 版)
産出

単体のカリウムは、カリウムのその強い反応性のために自然中からは産出しない[18]。カリウムはさまざまな化合物として地殻のおよそ2.6 %を占めており、地殻の2.8 %を占めるナトリウムに次いで地殻中で7番目に存在量の多い元素である(地殻中の元素の存在度も参照)[33]。たとえば花崗岩はカリウムをおおよそ5 %と、地殻の平均量以上を含んでいる。金属カリウムは非常に電気的に陽性であり(電気陰性度)、また非常に反応性が高いため、鉱石から直接生産することは難しい[15]。
工業原料としてのカリウム資源はほぼすべて塩化カリウムの形で採取される。年間生産量は3500万トン(K2O換算、2008年)である[34]。2008年において、おもな産地はカナダ(30.0 %)、ロシア連邦(19.2 %)、ベラルーシ(14.2 %)である[34]。推定埋蔵量はK2O換算でおよそ180億トン[34]。カリウムは植物の成長に必須であるため、塩化カリウムの90 %以上はそのまま、もしくは硫酸カリウムの形で肥料(カリ肥料)として用いられる[35]。残りは水酸化カリウムを経由して、炭酸カリウムとなる。
商業生産

純粋なカリウム金属は水酸化カリウムの電気分解という、19世紀初期にハンフリー・デービーがカリウムを単離した方法とほぼ同じプロセスで単離することができる[15]。この電気分解による製法は1920年代に開発され産業規模で用いられていたものの、金属ナトリウムと塩化カリウムを化学平衡を利用して反応させることによる熱的方法が1950年代には主流となった。この方法は反応時間および反応に用いるナトリウムの量を変えることでナトリウム-カリウム合金も生産することができる。フッ化カリウムと炭化カルシウムの反応を利用するグリースハイマー法もまた、カリウムの生産に利用される[36][37]。

カリウム鉱山の採掘の結果生じた、主として塩化ナトリウムからなるボタ山(ドイツ) さまざまな方法でカリウム塩類をナトリウムおよびマグネシウム化合物から分離し、それによって生じたナトリウムやマグネシウムの副産物は地下に保存されるかボタ山に積み上げられる。採掘されたカリウム鉱石の大部分は処理されて最終的に塩化カリウムとなる。塩化カリウムは鉱山産業において、カリ(potash)、カリの塩(muriate of potash)もしくは単純にMOPと呼ばれる[36]。
試薬グレードの金属カリウムは、1ポンドあたりおよそ10ドル(1 kgあたり22ドル)で売られている。純度の低いものは相応に安く販売される。カリウム金属市場は、金属カリウムの長期保管が困難であるために不安定である。金属カリウムは、その表面で超酸化カリウムが形成されないように乾燥した不活性ガスもしくは無水の鉱油中で保存しなければならない。この超酸化物は引っかかれた際に爆発を起こす、感圧性の爆薬である。超酸化物の形成が引き起こす爆発は、時に消火の難しい火災を引き起こす[44]。
キログラム単位よりも多い量のカリウムは1 kgあたり700ドルと、非常に大きなコストが生じる。これは危険物の輸送に必要なコストのためである[45]。
カリウムと人体
人体で8番目もしくは9番目に多く含まれる元素であり、体重のおよそ0.2 %を占めている(すなわち、60 kgの成人ではおよそ120 gのカリウムが含まれる)[46]。これは硫黄や塩素と同程度の含有量であり、主要なミネラルでカリウムより多く含まれているのはカルシウムとリンのみである[47]。
神経伝達
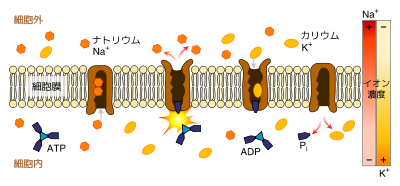
ナトリウム-カリウムポンプによるイオンの輸送 カリウムは人体に不可欠の電解質であり、脳および神経などにおけるニューロンの情報伝達に重要な役割を果たしている。カリウムはイオン(陽イオン)K+としておもに細胞内に分布しており、その濃度は細胞内液が100–150 mol/m3 と高濃度に保たれているのに対し、細胞外液の濃度は3.5–4.5 mol/m3程度と非常に小さく保たれている。これは、いわゆるナトリウム-カリウムイオンポンプの働きによるものである[48]。このイオンポンプは、アデノシン三リン酸(ATP)を1個消費して、ナトリウムイオン3個を細胞外へと運び出し、カリウムイオン2個を細胞内へと運び込む。このイオンポンプの働きによって細胞の内外にイオン濃度差が生じ、細胞膜上に電気的な勾配を発生させる。この電気勾配は通常時は静止電位と呼ばれる値に保たれているが、カリウムイオンチャネルが開くとカリウムイオン濃度の高い細胞内からカリウムイオン濃度の低い細胞外へと濃度勾配の方向にカリウムイオンが移動し、また、ナトリウムイオンチャネルが開くと、同様にナトリウム濃度の高い細胞外からナトリウムイオン濃度の低い細胞内へとナトリウムイオンが移動する。カリウムイオンはナトリウムイオンよりもイオン半径が大きく、その違いによって細胞膜のイオンポンプおよびイオンチャネルはこれらを区別することができ、一方を通過させてもう一方を通過させないように選択的に機能することが可能である[49]。このイオンチャネルの開閉による細胞内外のイオン濃度のバランスの変化によって膜電位(細胞外に対する細胞内電位)が変化し、それによって活動電位が発生(いわゆる「点火」)する。この活動電位が伝導することで情報が伝達されていく。活動電位が生じて細胞膜が脱分極(ナトリウムイオンの移動によって正の膜電位が発生)している場合には、カリウムイオンチャネルが開くことで再分極(膜電位が静止電位に戻る)させることになる。
また、右心房にある洞房結節から発生する活動電位によって心拍の調節が行われているが、そのためには適切なカリウムイオン濃度が必要である。静脈注射、あるいは何らかの異常によりカリウムイオンの血中濃度が過剰になる高カリウム血症となった場合、洞房結節のペースメーキングに変調を生じさせ、致命的な不整脈を引き起こしたり、心停止に至ることもある。また、心臓などの外科手術で心停止が必要な場合には塩化カリウムが用いられ、塩化カリウムはアメリカ合衆国において薬殺刑にも用いられる[50]。
摂取と健康
経口摂取の場合、吸収は比較的緩やかである。また、吸収後は細胞へ速やかに取り込まれることや、過剰分が腎臓のK+調節機能により排泄されることなどから、細胞外液中濃度は低レベルに維持される。1981年にモネル・ケミカル・センシズ・センターが発表したアルカリ金属のハロゲン化物に対する味覚調査によると、臭化カリウムおよび塩化カリウムの溶液に対する味覚は、濃度が希薄な状態では苦味が強いが、濃くなるほど苦味が弱まって塩味が強くなる傾向が示された[51][52]。
一日の所要量は約0.8–1.6 gとされる[53]。2016年3月更新の厚生労働省「日本人の食事摂取基準」によると、目安量は男性3000 mg/日、女性2600 mg/日(いずれも15歳以上)と勧告されている[53]が、アメリカ、イギリスでは生活習慣病予防の観点から、男女ともに目安量4700 mg/日、推奨量3500 mg/日としている[53]。植物、動物の細胞には豊富に含まれており、通常の食事で生命を維持するために必要なカリウムは十分に賄われる。そのため、カリウムの血中濃度の低下による低カリウム血症(カリウム欠乏症)の顕著な徴候や症状が健康な人に現れることは稀である[53]。カリウムの豊富な食品として、パセリや乾燥させたアンズ、粉ミルク、チョコレート、木の実(特にアーモンドとピスタチオ)、ジャガイモ、タケノコ、バナナ、アボカド、ダイズ、糠などに特に多く含まれるが、大部分の果実、野菜、肉、魚において人体に十分な量が含まれている[54]。なお、カリウムの最適摂取量に関しては、いくつかの議論が存在する。たとえば、アメリカ医学研究所は2004年にカリウムの食事摂取量基準を1日あたり4000 mg(100 mEq)と指定したが、アメリカ人の平均的カリウム摂取量はその半分程度しかないため、大部分が摂取不足であることになる[55]。同様に欧州連合、特にドイツとイタリアにおいても、カリウムは一般的に摂取不足の傾向にあると考えられている[56]。
高血圧についての疫学的研究および動物実験の結果、カリウム含有量の高い食品の摂取によって高血圧のリスクを低減できることが示され、高血圧を原因としない脳卒中についても低減されると考えられている。イタリアの研究者によるメタアナリシスに基づいた報告(2011年)によると、一日に1.46 g以上カリウムを摂取すると脳卒中のリスクが21 %低減するとされる[57]。また、ラットを用いた研究において、カリウムの欠乏はチアミン(ビタミンB1)の摂取不足と複合すると心臓病を誘発することが示された[58]。
サプリメント
医薬的用途のカリウムサプリメントはループ利尿薬やサイアザイド利尿薬と併用して使われることが多い。これは、利尿剤の薬効として尿が体外へ排出される際に副作用として排出されてしまうカリウムの補充を目的としている。典型的な医薬用サプリメントは、一回につき400 mg(10 mgEq、牛乳250 mLや100 %オレンジジュース200 mLに含まれるカリウムとほぼ同等)から800 mg(20 mgEq)の範囲で服用される。多くのサプリメントに使われている塩化カリウムは、胃や腸の粘膜に刺激を与えるため、消化管通過障害のある患者には禁忌である。また、カリウムイオンが高濃度となることで細胞破壊を引き起こす恐れもあるため、一般的に、浸出を緩やかにするタブレットやカプセルなどの形態で提供される。
非医薬的用途としてもカリウムサプリメントは広く利用されている。塩化カリウムのようなカリウム塩は水によく溶けるものの、濃度の高い溶液では味覚(苦味と塩味)を刺激するため、サプリメント飲料などにおいては、経口摂取の障害とならないよう口当たりをよくする研究も行われている[59][60]。なお、健康的な悪影響を避けるため、アメリカでは処方箋不要なカリウム錠のカリウム含有量を一錠あたり99 mg以下に法規制している。
過剰摂取と欠乏症
体内のカリウム濃度が高まると高カリウム血症が引き起こされ、致命的な不整脈を誘発する危険がある[61]。健康であれば、カリウムを過剰に摂取しても腎臓の調節機能によりカリウム濃度は抑制されているが、腎臓病の患者においては、腎不全によってカリウム濃度の制御機能が低下しているため対応できない。このような腎不全による高カリウム血症の対症療法として、カリウムの摂取制限やカリウムイオン交換樹脂薬の服用などが行われる[62]。
一方、嘔吐、下痢、多尿症などによって引き起こされる体液中のカリウム不足は、低カリウム血症として知られる致命的な状態を引き起こすことがある[63]。これは、カリウムが生体の神経伝達において非常に重要な役割を担っていることと関連している。カリウム欠乏の徴候としては、筋力の低下、イレウス(腸閉塞)、心電図の異常、反射機能の低下が挙げられ、重度の場合では呼吸困難やアルカローシス、不整脈も認められる[64]。
- ^ Haynes, William M., ed (2011). 化学と物理のCRCハンドブック (92nd ed.). CRC Press. p. 4.122. ISBN 1439855110
- ^ Davy, Humphry (1808). “On some new phenomena of chemical changes produced by electricity, in particular the decomposition of the fixed alkalies, and the exhibition of the new substances that constitute their bases; and on the general nature of alkaline bodies”. Philosophical Transactions of the Royal Society 98: 32. doi:10.1098/rstl.1808.0001.
- ^ a b c 村上雅人『元素を知る事典: 先端材料への入門』海鳴社、2004年、100頁。ISBN 9784875252207。
- ^ Klaproth, M. (1797) "Nouvelles données relatives à l'histoire naturelle de l'alcali végétal" (New data regarding the natural history of the vegetable alkali), Mémoires de l'Académie royale des sciences et belles-lettres (Berlin), pp. 9–13 ; see p. 13. From p. 13: "Cet alcali ne pouvant donc plus être envisagé comme un produit de la végétation dans les plantes, occupe une place propre dans la série des substances primitivement simples du règne minéral, &I il devient nécessaire de lui assigner un nom, qui convienne mieux à sa nature.
La dénomination de Potasche (potasse) que la nouvelle nomenclature françoise a consacrée comme nom de tout le genre, ne sauroit faire fortune auprès des chimistes allemands, qui sentent à quel point la dérivation étymologique en est vicieuse. Elle est prise en effet de ce qu'anciennement on se servoit pour la calcination des lessives concentrées des cendres, de pots de fer (pott en dialecte de la Basse-Saxe) auxquels on a substitué depuis des fours à calciner.
Je propose donc ici, de substituer aux mots usités jusqu'ici d'alcali des plantes, alcali végétal, potasse, &c. celui de kali, & de revenir à l'ancienne dénomination de natron, au lieu de dire alcali minéral, soude &c."
(This alkali [i.e., potash] — [which] therefore can no longer be viewed as a product of growth in plants — occupies a proper place in the originally simple series of the mineral realm, and it becomes necessary to assign it a name that is better suited to its nature.
The name of "potash" (potasse), which the new French nomenclature has bestowed as the name of the entire species [i.e., substance], would not find acceptance among German chemists, who feel to some extent [that] the etymological derivation of it is faulty. Indeed, it is taken from [the vessels] that one formerly used for the roasting of washing powder concentrated from cinders: iron pots (pott in the dialect of Lower Saxony), for which roasting ovens have been substituted since then.
Thus I now propose to substitute for the until now common words of "plant alkali", "vegetable alkali", "potash", etc., that of kali ; and to return to the old name of natron instead of saying "mineral alkali", "soda", etc.) - ^ Davy, Humphry (1809). “Ueber einige neue Erscheinungen chemischer Veränderungen, welche durch die Electricität bewirkt werden; insbesondere über die Zersetzung der feuerbeständigen Alkalien, die Darstellung der neuen Körper, welche ihre Basen ausmachen, und die Natur der Alkalien überhaupt [On some new phenomena of chemical changes that are achieved by electricity; particularly the decomposition of flame-resistant alkalis [i.e., alkalies that cannot be reduced to their base metals by flames, the preparation of new substances that constitute their [metallic] bases, and the nature of alkalies generally]”]. Annalen der Physik 31 (2): 113–175. Bibcode: 1809AnP....31..113D. doi:10.1002/andp.18090310202. "p. 157: In unserer deutschen Nomenclatur würde ich die Namen Kalium und Natronium vorschlagen, wenn man nicht lieber bei den von Herrn Erman gebrauchten und von mehreren angenommenen Benennungen Kali-Metalloid and Natron-Metalloid, bis zur völligen Aufklärung der chemischen Natur dieser räthzelhaften Körper bleiben will. Oder vielleicht findet man es noch zweckmässiger fürs Erste zwei Klassen zu machen, Metalle und Metalloide, und in die letztere Kalium und Natronium zu setzen. — Gilbert. (In our German nomenclature, I would suggest the names Kalium and Natronium, if one would not rather continue with the appellations Kali-metalloid and Natron-metalloid which are used by Mr. Erman [i.e., German physics professor Paul Erman (1764–1851)] and accepted by several [people], until the complete clarification of the chemical nature of these puzzling substances. Or perhaps one finds it yet more advisable for the present to create two classes, metals and metalloids, and to place Kalium and Natronium in the latter — Gilbert.)"
- ^ Berzelius, J. Jacob (1814) Försök, att, genom användandet af den electrokemiska theorien och de kemiska proportionerna, grundlägga ett rent vettenskapligt system för mineralogien [Attempt, by the use of electrochemical theory and chemical proportions, to found a pure scientific system for mineralogy]. Stockholm, Sweden: A. Gadelius., p. 87.
- ^ 19. Kalium (Potassium) – Elementymology & Elements Multidict. vanderkrogt.net
- ^ McNaught, A. D. and Wilkinson,A. eds. (1997). Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). IUPAC. Blackwell Scientific Publications, Oxford.
- ^ a b 櫻井、鈴木、中尾 (2003) 24頁。
- ^ James, Arthur M.; Lord, Mary P. (1992). Macmillan's Chemical and Physical Data. London: Macmillan. ISBN 0-333-51167-0
- ^ a b Dye, J. L. (1979). “Compounds of Alkali Metal Anions”. Angewandte Chemie International Edition 18 (8): 587–598. doi:10.1002/anie.197905871.
- ^ 千谷 (1959) 83頁。
- ^ Helmenstine, Anne Marie. “Qualitative Analysis – Flame Tests”. About.com. 2011年5月9日閲覧。
- ^ コットン、ウィルキンソン (1987) 249-250頁。
- ^ a b c Winter, Mark. “Potassium: Key Information”. Webelements. 2011年5月8日閲覧。
- ^ Davy (1808) p. 25.
- ^ a b ショアー、ボルハルト (2004) 361頁。
- ^ a b c d Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). “Potassium” (German). Lehrbuch der Anorganischen Chemie (91-100 ed.). Berlin: Walter de Gruyter. ISBN 3-11-007511-3
- ^ Burkhardt (2006) p. 35.
- ^ 化学大辞典編集委員会 (編)『化学大辞典』共立出版、1993年。
- ^ コットン、ウィルキンソン (1987) 253頁。
- ^ Burkhardt (2006) p. 32.
- ^ 日本工業規格、JIS K0102 工場排水試験方法。
- ^ 日本工業規格、JIS K0400-49-20 水質―ナトリウム及びカリウムの定量―第2部:原子吸光法によるカリウムの定量。
- ^ 日本分析化学学会 (2008) 97頁。
- ^ 榊徹 (2003年). “イオン選択電極”. エーアンドティー. p. 5. 2011年9月28日閲覧。
- ^ 日本分析化学学会 (2008) 106頁。
- ^ レイナーキャム無機化学(原著第4版). 株式会社 東京化学同人. (2016年10月20日)
- ^ Cameron, A. G. W. (June 1957). Stellar Evolution, Nuclear Astrophysics, and Nucleogenesis. Chalk River Laboratory report CRL-41
- ^ a b c Georges, Audi (2003). “The NUBASE Evaluation of Nuclear and Decay Properties”. Nuclear Physics A (Atomic Mass Data Center) 729: 3-128. Bibcode: 2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ President and Fellows Harvard College. “Radioactive Human Body”. Harvard Natural Sciences Lecture Demonstrations. 2011年10月1日閲覧。
- ^ Winteringham, F. P. W. (1989). Radioactive fallout in soils, crops and food. FAO Soils Bulletin 61. Rome: Food and Agriculture Organization of the United Nations. p. 32. ISBN 9789251028773 2011年5月15日閲覧。
- ^ Monroe, James Stewart; Wicander, Reed; Hazlett, Richard W. (2007). Physical Geology: Exploring the Earth (6th ed. ed.). Belmont, CA: Thomson Brooks/Cole. p. 80. ISBN 9780495011484
- ^ a b c “自然起源放射性物質データベース(窒素肥料・リン酸肥料・カリ肥料)” (pdf). 独立行政法人 放射線医学総合研究所. pp. 10-11. 2011年5月8日閲覧。
- ^ “SIDS 初期評価プロファイル 塩化カリウム” (pdf). 一般社団法人 日本化学物質安全・情報センター. p. 2. 2011年5月8日閲覧。
- ^ a b c Prud'homme, Michel; Krukowski, Stanley T. (2006). “Potash”. In Kogel, Jessica Elzea; Trivedi, Nikhil C.; Barker, James M.; Krukowsk, Stanley T.. Industrial Minerals & Rocks. Littleton, CO: Society for Mining, Metallurgy, and Exploration. pp. 723–740. ISBN 9780873352338
- ^ Burkhardt, Elizabeth R. (2003). “Potassium and Potassium Alloys”. In Ullmann, Fritz; Bohnet, Matthias. Ullmann's encyclopedia of industrial chemistry. 29. Weinheim: Wiley-VCH. p. 83
- ^ Garrett, Donald E. (1996). Potash: deposits, processing, properties and uses. London: Chapman & Hall. ISBN 9780412990717
- ^ Wishart, David J. (2004). Encyclopedia of the Great Plains. University of Nebraska Press. p. 433. ISBN 9780803247871
- ^ Ober, Joyce A. (2008年). “Mineral Commodity Summaries 2008: Potash”. United States Geological Survey. 2008年11月20日閲覧。
- ^ Micale, Giorgio; Cipollina, Andrea; Rizzuti, Lucio (2009). Cipollina, Andrea; Micale, Giorgio; Rizzuti, Lucio. ed. Seawater Desalination: Conventional and Renewable Energy Processes. Berlin: Springer. p. 3. ISBN 9783642011498
- ^ a b Ober, Joyce A. (2007年). “Mineral Yearbook 2006: Potash”. United States Geological Survey. 2008年11月20日閲覧。
- ^ 荻野博『典型元素の化合物』岩波講座 現代科学への入門 11、岩波書店、2004年、150頁。ISBN 4-00-011041-1。
- ^ “Potassium Metal 98.50% Purity”. Galliumsource.com. 2010年10月16日閲覧。
- ^ “004 – Potassium Metal”. Mcssl.com. 2010年10月16日閲覧。
- ^ Abdelwahab, M.; Youssef, S.; Aly, A.; Elfiki, S.; Elenany, N.; Abbas, M. (1992). “A simple calibration of a whole-body counter for the measurement of total body potassium in humans”. International Journal of Radiation Applications and Instrumentation. Part A. Applied Radiation and Isotopes 43 (10): 1285-1289. doi:10.1016/0883-2889(92)90208-V.
- ^ Chang, Raymond (2007). Chemistry. Boston: McGraw-Hill Higher Education. p. 52. ISBN 9780071105958 2011年5月29日閲覧。
- ^ Campbell, Neil (1987). Biology. Menlo Park: Benjamin/Cummings. p. 795. ISBN 0-8053-1840-2
- ^ Lockless, S. W.; Zhou, M.; MacKinnon, R. (2007). “Structural and thermodynamic properties of selective ion binding in a K+ channel”. PLoS Biol 5 (5): e121. PMID 17472437.
- ^ Schonwald, Seth (2004). “Potassium Chloride and Potassium Permanganate”. Medical toxicology. Philadelphia: Lippincott Williams & Wilkins. pp. pp. 903-905. ISBN 9780781728454
- ^ Marfy, Claire; Cardello, A. V.; Brand, Joseph G. (1981). “Tastes of Fifteen Halide Salts Following Water and NaCl: Anion and Cation Effects”. Physiology & Behavior 26: 1083-1095.
- ^ 橋本壽夫 (2008年10月25日). “塩・話・解・題 43 ハロゲン化合物の味と安全性”. たばこ塩産業新聞 塩事業版 (JTクリエイティブサービス) 2011年8月25日閲覧。
- ^ a b c d 「日本人の食事摂取基準」策定検討会: “日本人の食事摂取基準”. 厚生労働省. pp. 252-255 (2016年). 2018年5月1日閲覧。
- ^ “Potassium Food Charts”. Asia Pacific Journal of Clinical Nutrition. 2011年5月18日閲覧。
- ^ Grim, C. E.; Luft, F. C.; Miller, J. Z.; Meneely, G. R.; Battarbee, H. D.; Hames, C. G.; Dahl, L. K. (1980). “Racial differences in blood pressure in Evans County, Georgia: relationship to sodium and potassium intake and plasma renin activity”. Journal of Chronicle Diseases 33 (2): 87-94. doi:10.1016/0021-9681(80)90032-6. PMID 6986391.
- ^ Karger, S. (2004). “Energy and nutrient intake in the European Union” (PDF). Annals of Nutrition and Metabolism 48 (2 (suppl)): 1-16. doi:10.1159/000083041.
- ^ D'Elia, L.; Barba, G.; Cappuccio, F.; Strazzullo, P. (2011). “Potassium Intake, Stroke, and Cardiovascular Disease: A Meta-Analysis of Prospective Studies”. The Journal of the American College of Cardiology 57 (10): 1210-1219. doi:10.1016/j.jacc.2010.09.070.
- ^ Folis, R. H. (1942). “Myocardial Necrosis in Rats on a Potassium Low Diet Prevented by Thiamine Deficiency”. Bulletin of the Johns-Hopkins Hospital 71: 235.
- ^ Committee on Optimization of Nutrient Composition of Military Rations for Short-Term, High-Stress Situations; Committee on Military Nutrition Research (2006). Nutrient composition of rations for short-term, high-intensity combat operations. Washington, D.C.: National Academies Press. pp. pp. 287 ff. ISBN 9780309096416 2011年5月29日閲覧。
- ^ Shallenberger, R. S. (1993). Taste chemistry. London: Blackie Academic & Professional. pp. pp. 120 ff. ISBN 9780751401509 2011年5月29日閲覧。
- ^ 中屋豊『よくわかる栄養学の基本としくみ』秀和システム、2009年、167頁頁。ISBN 9784798022871。
- ^ 嶋津孝、下田妙子『臨床栄養学 疾病編』(第2版)化学同人〈エキスパート管理栄養士養成シリーズ〉、2010年、159頁。ISBN 4759812296。
- ^ Slonim, Anthony D.; Pollack, Murray M. (2006). “Potassium”. Pediatric critical care medicine. Philadelphia, PA: Lippincott Williams & Wilkins. p. 812. ISBN 9780781794695
- ^ Visveswaran, Kasi (2009). “hypokalemia”. Essentials of Nephrology (2nd ed. ed.). New Delhi: BI Publications. p. 257. ISBN 9788172253233
- ^ a b c 岐阜県街路樹等整備・管理の手引き 岐阜県建設研究センター、岐阜県造園緑化協会、2022年4月23日閲覧。
- ^ “年報 平成20年”. 経済産業省生産動態統計. 2011年6月10日閲覧。
- ^ a b c d Greenwood (1997) p.73
- ^ 千谷 (1959) 108頁。
- ^ 足立、岩倉、馬場 (2004) 52頁。
- ^ Roy, Amit H. (2007). “Fertilizers and Food Production”. In Kent, James A.. Kent and Riegel's handbook of industrial chemistry and biotechnology. 1. New York: Springer. pp. pp. 1111-1157. ISBN 9780387278438
- ^ “施肥量決定の考え方、方法等”. 三重県中央農業改良普及センター. p. 78. 2011年6月29日閲覧。
- ^ “Potassium Content of Selected Foods per Common Measure, sorted by nutrient content”. USDA National Nutrient Database for Standard Reference, Release 20
- ^ Figoni, Paula I. (2010). “Bleaching and Maturing Agents”. How Baking Works: Exploring the Fundamentals of Baking Science. Hoboken: John Wiley & Sons. p. 86. ISBN 9780470392676
- ^ Chichester, C. O. (1986). “Uses and Exposure to Sulfites in Food”. Advances in Food Research. 30. Orlando: Academic Press. pp. pp. 4-6. ISBN 9780120164301
- ^ Kearey, Philip; Brooks, M.; Hill, Ian (2002). “Optical Pumped Magnetometer”. An introduction to geophysical exploration. Oxford: Blackwell Science. p. 164. ISBN 9780632049295
- ^ Werner, R. C.; Jackson, C. B. (1957). “Chapter 18. The Manufacture of Potassium and NaK”. Advances in Chemistry. 19. pp. pp. 169-173. doi:10.1021/ba-1957-0019.ch018. ISBN 9780841200203 ISBN 9780841221666.
- ^ Greenwood (1997) p. 76.
- ^ Siegel, Richard S. (1940). “Ignition of the safety match”. Journal of Chemical Education 17 (11): 515. doi:10.1021/ed017p515.
- ^ Toedt, John; Koza, Darrell; Cleef-Toedt, Kathleen Van (2005). “Personal Cleansing Products: Bar Soap”. Chemical Composition of Everyday Products. Westport: Greenwood Press. ISBN 9780313325793
- ^ 千谷 (1959) 114頁。
- ^ 職業能力開発総合大学校能力開発研究センター 編『めっき科電気めっき作業法-2級技能士コース』職業訓練教材研究会、2005年、223頁。ISBN 4786330043。
- ^ 加藤俊二『身の回りを化学の目で見れば』化学同人、1986年、162頁。ISBN 4759801553。
- ^ Greenwood (1997) p.74
- ^ Marx, Robert F. (1990). The History of Underwater Exploration. New York: Dover Publications. ISBN 9780486264875
- ^ Gettens, Rutherford John; Stout, George Leslie (1966). Painting Materials: A Short Encyclopaedia. New York: Dover Publications. pp. pp. 109-110. ISBN 9780486215976
- ^ 櫻井、鈴木、中尾 (2003) 128頁。
- ^ コットン、ウィルキンソン (1987) 264頁。
- ^ ショアー、ボルハルト (2004) 359-361頁。
- ^ ショアー、ボルハルト (2004) 360頁。
- ^ 薬事日報社 編『医薬部外品原料規格-2006追補』薬事日報社、2009年、16頁。ISBN 4840811016。
- ^ 厚生労働省 編『食品衛生検査指針 理化学編 2005』日本食品衛生協会、2005年、76-77頁。ISBN 4889250034。
- ^ 萩中淳『分析科学』化学同人、2007年、294頁。ISBN 4759812520。
- ^ 本浄高治『基礎分析化学』化学同人、1998年、80-82頁。ISBN 4759808205。
- ^ Bowen, Robert (1988). “Theory and Assumptions in Potassium-Argon Dating”. Isotopes in the Earth Sciences. London: Chapman & Hall. pp. pp. 203-208. ISBN 9780412537103
- ^ A temperature below absolute zero Max Plank Gesellscaft
- ^ Purefoy, Christian (2010年11月26日). “Nigeria's 500-year-old dye tradition under threat”. CNN 2011年10月1日閲覧。
- ^ Marggraf, Andreas Siegmund (1761). Chymischer Schriften. Berlin: Bey Arnold Wever. p. 167
- ^ du Monceau, H. L. D. (1736). “Sur la Base de Sel Marine” (French). Memoires de l'Academie royale des Sciences: 65-68.
- ^ Enghag, P. (2004). “11. Sodium and Potassium”. Encyclopedia of the Elements. Weinheim: Wiley-VCH. ISBN 3527306668
- ^ Davy (1808) pp. 1–44.
- ^ a b Shaposhnik, V. A. (2007). “History of the discovery of potassium and sodium (on the 200th anniversary of the discovery of potassium and sodium)”. Journal of Analytical Chemistry 62 (11): 1100-1102. doi:10.1134/S1061934807110160.
- ^ Weeks, Mary Elvira (1932). “The discovery of the elements. XI. Some elements isolated with the aid of potassium and sodium: Zirconium, titanium, cerium, and thorium”. Journal of Chemical Education 9 (7): 1231. doi:10.1021/ed009p1231.
- ^ Siegfried, R. (1963). “The Discovery of Potassium and Sodium, and the Problem of the Chemical Elements”. Isis 54 (2): 247-258. doi:10.1086/349704. JSTOR 228541.
- ^ Browne, C. A. (1926). “Historical notes upon the domestic potash industry in early colonial and later times”. Journal of Chemical Education 3 (7): 749. doi:10.1021/ed003p749.
- ^ “石鹸の歴史”. 石鹸百科. 生活と科学社 (2009年). 2011年9月29日閲覧。
- ^ Liebig, Justus von (1840). Die organische Chemie in ihrer Anwendung auf Agricultur und Physiologie. Braunschweig: Vieweg
- ^ Cordel, Oskar (1868). Die Staßfurter Kalisalze in der Landwirthschaft. Aschersleben, Germany: L. Schnock
- ^ Birnbaum, Karl (1869). Die Kalidüngung in ihren Vortheilen und Gefahren. Berlin: Wiegandt & Hempe
- ^ United Nations Industrial Development Organization; Int'l Fertilizer Development Center (1998). Fertilizer Manual. Dordrecht, The Netherlands: Kluwer Academic Publishers. pp. pp. 46 ff, 417 ff. ISBN 9780792350323
- ^ Miller, H. (1980). “Potash from Wood Ashes: Frontier Technology in Canada and the United States”. Technology and Culture 21 (2): 187-208. doi:10.2307/3103338. JSTOR 3103338.
- ^ Rittenhouse, P. A. (1979). “Potash and politics”. Economic Geology 74 (2): 353-357. doi:10.2113/gsecongeo.74.2.353.
- ^ “消防法(昭和二十三年法律第百八十六号)”. e-Gov法令検索. 総務省行政管理局 (2018年6月27日). 2020年2月10日閲覧。 “2019年7月1日施行分”
- ^ “毒物及び劇物取締法(昭和二十五年法律第三百三号)”. e-Gov法令検索. 総務省行政管理局 (2018年6月27日). 2020年2月10日閲覧。 “2016年4月1日施行分”
- ^ “Alkali Metals Sodium, Potassium, NaK, and Lithium”. DOE Handbook. Washington, D.C.: U.S. Department of Energy (1994年). 2010年10月16日閲覧。
- ^ Wray, Thomas K. (1992年). “Danger: peroxidazable chemicals”. Environmental Health & Public Safety (North Carolina State University). 2011年5月16日閲覧。
カリウムと同じ種類の言葉
- カリウムのページへのリンク