トリクロロビスムチン
塩化ビスマス(III)
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/09/18 00:01 UTC 版)

|
この項目「塩化ビスマス(III)」は翻訳されたばかりのものです。不自然あるいは曖昧な表現などが含まれる可能性があり、このままでは読みづらいかもしれません。(原文:en:Bismuth chloride 05:42, 26 July 2025 UTC)
修正、加筆に協力し、現在の表現をより自然な表現にして下さる方を求めています。ノートページや履歴も参照してください。(2025年9月) |
| 塩化ビスマス(III) | |
|---|---|
 |
|
 |
|
|
Bismuth chloride |
|
|
別称
三塩化ビスマス、トリクロロビスマス、トリクロロビスムチン
|
|
| 識別情報 | |
|
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.029.203 |
|
PubChem CID
|
|
| RTECS number |
|
| UNII | |
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| 特性 | |
| 化学式 | BiCl3 |
| モル質量 | 315.34 g/mol |
| 外観 | 吸湿性の白黄色結晶 |
| 密度 | 4.75 g/cm3 |
| 融点 | 227 °C, 500 K, 441 °F |
| 沸点 | 447 °C, 720 K, 837 °F |
| 水への溶解度 | 可溶、加水分解 |
| 溶解度 | メタノール、ジエチルエーテル、アセトンに可溶 |
| 磁化率 | −26.5·10−6 cm3/mol |
| 構造 | |
| 立方晶系 | |
| 熱化学 | |
| 標準定圧モル比熱, Cp |
0.333 J/(g K) |
| 標準モルエントロピー S |
82.9 J/(K mol) |
|
標準生成熱 (ΔfH⦵298)
|
−1.202 kJ/g |
| 危険性 | |
| NFPA 704(ファイア・ダイアモンド) | |
| 致死量または濃度 (LD, LC) | |
|
半数致死量 LD50
|
3324 mg/kg, 経口投与 (ラット) |
| 安全データシート (SDS) | JT Baker |
| 関連する物質 | |
| その他の 陰イオン |
フッ化ビスマス(III) 次サリチル酸ビスマス 酸化ビスマス(III) |
| その他の 陽イオン |
塩化鉄(III) 塩化マンガン(II) 塩化コバルト(II) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
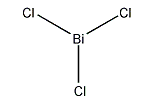
塩化ビスマス(III)(えんかビスマス、英語: bismuth(III) chloride)は、化学式BiCl3で表される無機化合物である。共有結合性の化合物であり、Bi3+イオンの一般的な供給源となる。気体または結晶中では、VSEPR則に従いピラミッド型の構造を持つ。
合成
塩化ビスマス(III)は、塩素をビスマスに通すことで直接合成することができる。
- 2 Bi + 3 Cl2 → 2 BiCl3
もしくは、王水中でビスマス金属を溶解させ、混合物を蒸発させてBiCl3·2H2Oを得て、これを蒸留することで無水物の塩化ビスマス(III)が得られる[1]。
あるいは、酸化ビスマス(III)に塩酸を加え、溶液を蒸発させることでも得られる。
- Bi2O3 + 6 HCl → 2 BiCl3 + 3 H2O
また、ビスマスを濃硝酸に溶かし、固体の塩化ナトリウムを溶液に加えることでも得ることができる[2]。
- Bi + 6 HNO3 → Bi(NO3)3 + 3 H2O + 3 NO2
- Bi(NO3)3 + 3 NaCl → BiCl3 + 3 NaNO3
構造
気相において、結合角97.5°、結合長242 pmのCi-Bi-Cl結合を持つピラミッド構造をとる[3]。固相においては、それぞれのビスマス原子が250 pm、324 pm、また平均336 pmに位置する三つの隣接する原子を持ち[4]、上記の画像は三つの隣接する原子を強調している。このような構造は、塩化ヒ素(III)、臭化ヒ素(III)、塩化アンチモン(III)、臭化アンチモン(III)の構造に類似する。
化学的性質
塩化ビスマス(III)は、容易に塩化酸化ビスマスに加水分解する[5]。
- Bi3+(aq) + Cl−(aq) + H2O(l) ⇌ BiOCl (s) + 2 H+(aq)
この反応は、塩酸などの酸を加えることで逆反応を起こすことができる[6]。
固体の塩化ビスマス(III)と50℃未満の水蒸気との反応は、一水和物の中間体BiCl3·H2Oを生成する[7]。
塩化ビスマス(III)は酸化剤であり、還元剤によって容易に金属ビスマスへ還元される。
錯体
傾向から予想されるのとは対照的に、塩化ビスマス(III)はルイス酸であり、オクテット則に反する[BiCl6]3−のような様々な塩素錯体を形成する。さらに、これらの錯体の八面体構造は、ビスマスの孤立電子対が予期せず立体化学的に不活性であるため、VSEPR則の予測に従わない。しかし、2価の陰イオンの[BiCl5]2−は、予測通りの方錐構造をとる[8]。
 |
 |
 |
| Cs3[BiCl6] | Cs3[BiCl6] | [BiCl6]3− |
有機触媒作用
塩化ビスマス(III)は、有機合成における触媒として用いられ、特に、マイケル反応や向山アルドール反応を触媒する。他のヨウ化金属を加えることで、さらに触媒作用を高めることができる[9]。
脚注
- ^ Godfrey, S. M.; McAuliffe, C. A.; Mackie, A. G.; Pritchard, R. G. (1998). Nicholas C. Norman. ed. Chemistry of arsenic, antimony, and bismuth. Springer. p. 90. ISBN 0-7514-0389-X
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ Töke, Orsolya, and Magdolna Hargittai. "Molecular structure of bismuth trichloride from combined electron diffraction and vibrational spectroscopic study." Structural Chemistry 6.2 (1995): 127–130.
- ^ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition, pp. 879–884, Oxford Science Publications, ISBN 0-19-855370-6
- ^ Joel Henry Hildebrand (2008). Principles of Chemistry. BiblioBazaar, LLC. p. 191. ISBN 978-0-559-31877-1
- ^ Frank Welcher (2008). Chemical Solutions. READ BOOKS. p. 48. ISBN 978-1-4437-2907-9
- ^ Wosylus, Aron; Hoffmann, Stefan; Schmidt, Marcus; Ruck, Michael (2010). “In-situ Study of the Solid-Gas Reaction of BiCl3 to BiOCl via the Intermediate Hydrate BiCl3·H2O”. European Journal of Inorganic Chemistry 2010 (10): 1469–1471. doi:10.1002/ejic.201000032. ISSN 1434-1948.
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Hitomi Suzuki; Yoshihiro Matano (2001). Organobismuth chemistry. Elsevier. pp. 403–404. ISBN 0-444-20528-4
- 塩化ビスマス(III)のページへのリンク