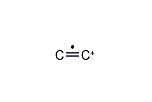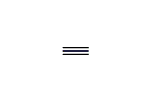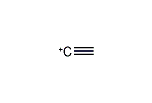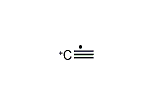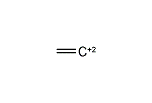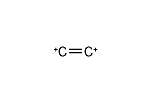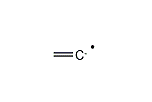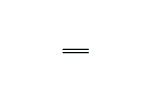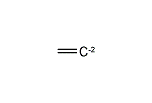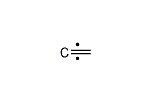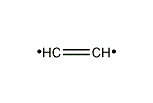(エテン-2-イリウム)-1-イルラジカル
アセチレン
アセチレンラジカルアニオン
| 分子式: | C2H2 |
| その他の名称: | Acetyleneradical anion、Ethyneradical anion、Acetylene-1-radical anion、Ethyne-1-radical anion |
| 体系名: | アセチレンラジカルアニオン、エチンラジカルアニオン、アセチレン-1-ラジカルアニオン、エチン-1-ラジカルアニオン |
エチン-1-イウム
エチン‐1‐ラジカルカチオン
エテン-1,1-ジイリウム
エテン‐1,2‐ジイリウム
エテン-1-イリド
ビニリデン
ビニリデンアニオン
| 分子式: | C2H2 |
| その他の名称: | Ethene-1,1-dianion、ビニリデンアニオン、Vinylidene anion、Ethene-1,1-diide |
| 体系名: | エテン-1,1-ジアニオン、エテン-1,1-ジイド |
ビニリデンラジカル
| 分子式: | C2H2 |
| その他の名称: | Vinylidene radical、Ethene-1,1-diyl radical、Ethenylidene radical |
| 体系名: | ビニリデンラジカル、エテン-1,1-ジイルラジカル、エテニリデンラジカル |
ビニレン
ビニレンラジカル
アセチレン
(c2-h2 から転送)
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/05/27 14:15 UTC 版)
| アセチレン | |
|---|---|
 |
|
 |
|
 |
|
|
Acetylene
|
|
| 識別情報 | |
| CAS登録番号 | 74-86-2  |
| ChemSpider | 6086  |
| UNII | OC7TV75O83  |
| 国連/北米番号 | 1001 (dissolved) 3138 (in mixture with ethylene and propylene) |
| KEGG | C01548  |
| ChEBI | |
| ChEMBL | CHEMBL116336  |
|
|
|
|
| 特性 | |
| 化学式 | C2H2 |
| モル質量 | 26.04 g mol−1 |
| 密度 | 1.097 kg m−3 |
| 融点 | −80.8 °C, 192.4 K, −113.4 °F (三重点) |
| 沸点 | −84 °C, 189 K, -119 °F (昇華) |
| 酸解離定数 pKa | 25 |
| 構造 | |
| 分子の形 | 直線形 |
| 熱化学 | |
| 標準生成熱 ΔfH |
+226.88 kJ/mol |
| 危険性 | |
| NFPA 704 | |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
アセチレン(英: acetylene)は炭素数が2のアルキンである。IUPAC系統名はエチン ethyne、分子式は C2H2である。1836年にイギリスのエドモンド・デービーによって発見され、水素と炭素の化合物であるとされた。1860年になってマルセラン・ベルテロが再発見し、「アセチレン」と命名した。アルキンのうち工業的に最も重要なものである。
酸素と混合し、完全燃焼させた場合の炎の温度は3,330 ℃にも及ぶため、その燃焼熱を目的として金属加工工場などで多く使われる。高圧ガス保安法により、常用の温度で圧力が0.2 MPa以上になるもので、現に0.2 MPa以上のもの、または、15 ℃で0.2 MPa以上となるものである場合、褐色のボンベに保管することが定められている。
構造
構造式は HC≡CH で、炭素-炭素間で三重結合を1個だけ持つ直線型分子。炭素‐炭素間でπ結合を二つ持ち、sp混成軌道を取り、結合角は180° である。アルキンのうち最も簡単なものであり、異性体は存在しない。
物理的性質
常温では水に体積比 1:1 の割合で溶ける。テトラヒドロフランなどの有機溶媒にはより溶けやすい。爆発範囲は 2.5–81 vol%(空気中)である。純粋なものは無臭だが、市販されているものは通常硫黄化合物などの不純物を含むため、特有のにおいを持つ。
化学的性質
アセチレンや一般のアルキンは三重結合を持つ不飽和炭化水素のため反応性が大きく、さまざまな物質の合成の原料となる。銀、銅、水銀等の金属や金属化合物と反応し、爆発性のある金属アセチリドを生成する。人体に対して有害性はないが、可燃性である。
付加反応
アセチレンの三重結合は付加反応を受けやすい。ニッケルを触媒として水素を付加させるとエチレンになり、さらに水素を付加させるとエタンになる。
-

ユニオンカーバイド社のアセチレンランプの広告 かつては アセチレンランプ(カーバイドランプ)として照明用に使われていた。アセチレンランプは、上部と下部に分かれ、上部の水が下部のカルシウムカーバイドに滴り落ちアセチレンが発生するのを利用している。光量の調節が容易なため、高性能の蓄電池や送電線が普及するまでは、炭鉱の坑内灯や携帯灯具(カンテラ)、蒸気機関車や自動車の前照灯などにも使われた。街灯としては、1897年7月24日にハンガリーのタタに、1898年には英国のノース・ペザトンに設置されている。- スウェーデンのニルス・グスタフ・ダレーンは、1912年にアセチレンを利用した「灯台や灯浮標などの照明用ガス貯蔵器用の自動調節機の発明」でノーベル物理学賞を受賞した。
- 現在でも洞窟内探検(ケービング)でカンテラとして使用されることがある。
アセチレンから合成される化合物
参考文献
- ^ Acyclic Hydrocarbons. Rule A-3. Unsaturated Compounds and Univalent Radicals, IUPAC Nomenclature of Organic Chemistry
- ^ 社団法人日本溶接協会 監修『新版 ガス溶接技能者教本』改訂第2版,産報出版,p22
- ^ 泰碩, 功刀、朝也, 酒井「メタン化学の進歩」『有機合成化学協会誌』第20巻第5号、1962年、426–434頁、doi:10.5059/yukigoseikyokaishi.20.426。
- ^ 経済産業省生産動態統計年報 化学工業統計編
- ^ “高等学校の有機化学の誤りを正す アセチレンからエチレンへ”. 香川高等専門学校. 2022年12月19日閲覧。
関連項目
外部リンク
- c2-h2のページへのリンク