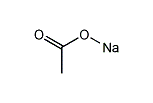
酢酸ナトリウム
酢酸ナトリウム
3M NaOAc調製法
種々のpHの0.2M NaOAcバッファー

CC Attribution-Noncommercial-Share Alike 3.0 Unported
酢酸ナトリウム
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/07/16 03:45 UTC 版)
| 酢酸ナトリウム | |
|---|---|
 |
|
 |
|
 |
|
|
Sodium acetate
|
|
|
Sodium ethanoate
|
|
|
別称
Hot ice (sodium acetate trihydrate)
|
|
| 識別情報 | |
|
3D model (JSmol)
|
|
| バイルシュタイン | 3595639 |
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.004.386 |
| EC番号 |
|
| E番号 | E262 (防腐剤) |
| Gmelin参照 | 20502 |
| KEGG |
|
|
PubChem CID
|
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| 特性 | |
| 化学式 | C2H3NaO2 |
| モル質量 | 82.03 g mol−1 |
| 外観 | 白色の潮解性粉末または結晶 |
| 匂い | 加熱分解時に酢酸臭[1] |
| 密度 | 1.528 g/cm3 (20 °C, 無水物) 1.45 g/cm3 (20 °C, 三水和物)[2][3] 1.28 g/cm3 (液体, 三水和物)[3] |
| 融点 | 324℃(無水物) |
| 沸点 | 881.4℃(無水物) |
| 水への溶解度 | 無水物: 119 g/100 mL (0 °C) 123.3 g/100 mL (20 °C) 125.5 g/100 mL (30 °C) 137.2 g/100 mL (60 °C) 162.9 g/100 mL (100 °C) 三水和物: 32.9 g/100 mL (-10 °C) 36.2 g/100 mL (0 °C) 46.4 g/100 mL (20 °C) 82 g/100 mL (50 °C)[4] |
| 溶解度 | アルコール, ヒドラジン, SO2に溶解[5] |
| メタノールへの溶解度 | 16 g/100 g (15 °C) 16.55 g/100 g (67.7 °C)[5] |
| エタノールへの溶解度 | 三水和物: 5.3 g/100 mL |
| アセトンへの溶解度 | 0.5 g/kg (15 °C)[5] |
| 酸解離定数 pKa | 24 (20 °C)[5] 4.75 (when mixed with CH3COOH as a buffer)[6] |
| 塩基解離定数 pKb | 9.25 |
| 磁化率 | −37.6·10−6 cm3/mol |
| 屈折率 (nD) | 1.464 |
| 構造 | |
| 単斜晶 | |
| 熱化学 | |
| 標準生成熱 ΔfH |
−709.32 kJ/mol (無水物)[5] −1604 kJ/mol (三水和物)[2] |
| 標準モルエントロピー S |
138.1 J/(mol·K) (無水物)[7] 262 J/(mol·K) (三水和物)[2] |
| 標準定圧モル比熱, Cp |
100.83 J/(mol·K) (無水物)[7] 229 J/(mol·K) (三水和物)[8] |
| 危険性 | |
| 労働安全衛生 (OHS/OSH): | |
|
主な危険性
|
刺激性 |
| NFPA 704(ファイア・ダイアモンド) | |
| 引火点 | >250 °C (482 °F; 523 K)[6] |
| 607 °C (1,125 °F; 880 K)[6] | |
| 致死量または濃度 (LD, LC) | |
|
半数致死量 LD50
|
3530 mg/kg (経口, ラット) >10000 mg/kg (ウサギ, 真皮) |
|
半数致死濃度 LC50
|
>30 g/m3 (ラット, 1 h) |
| 安全データシート (SDS) | Fisher Scientific |
| 関連する物質 | |
| その他の 陰イオン |
ギ酸ナトリウム プロピオン酸ナトリウム |
| その他の 陽イオン |
酢酸カリウム 酢酸カルシウム |
| 関連物質 | 二酢酸ナトリウム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |

酢酸ナトリウム(さくさんナトリウム、Sodium acetate)とは、酢酸とナトリウムのつくる塩である。酢酸ソーダとも言う。無水物と三水和物が存在する。
無水物、三水和物ともに無色の結晶である。
無水物、三水和物ともに水によく溶けるが、有機溶媒にはほとんど溶けない。弱酸と強塩基の塩なので、水溶液は弱アルカリ性を示す。
酢酸と水酸化ナトリウムまたは炭酸ナトリウムの中和により三水和物が得られ、この三水和物を120 °C – 250 °Cで加熱すると無水物となる。
用途
緩衝溶液の調製、染料の媒染剤に用いられるほか、融解熱が大きいので暖房器具の蓄熱、保温材としても使われる。漬物などの保存料がわりに使われることもある。
またポテトチップスの一部に酢酸ナトリウムが酸味として用いられる。[9]
蓄熱
酢酸ナトリウムは、蓄熱、エコカイロに使われている。酢酸ナトリウムの過飽和水溶液は結晶化によって相当な発熱を生じる。
酢酸ナトリウムの三水和物の結晶は58–58.4 °C (136.4–137.1 °F)で融解し[10][11]、液体酢酸ナトリウムは解放された結晶水に溶ける。融点を超えて加熱し、その後冷却させると、水溶液は過飽和状態になる。この水溶液は、結晶を形成することなく室温まで冷却することができる(過冷却)。カイロ内の金属片を押すことにより、核生成中心が形成され、溶液が結晶化して固体の酢酸ナトリウム三水和物に戻る。結晶化のプロセスは発熱反応である[12]。 融解熱は約264〜289kJ/kg(73〜80Wh/kg)である[10]。不可逆的な化学反応に依存するものなど、いくつかのタイプのカイロとは異なり、酢酸ナトリウムカイロは、結晶が完全に溶解するまで、沸騰したお湯に数分間浸し、ゆっくりと室温まで冷却させることによって、簡単に再利用することができる[13]。
三水和物の熱伝導率が0.2W/mKと水の1/3程度しか無いのが弱点。[14]
-
カイロと、封入されているコイン状衝撃材
-
結晶化の様子
過冷却(過飽和)
酢酸ナトリウムの過冷却温度は-10℃を容易に下回る。[15]
過冷却現象を利用することで断熱なしで熱を蓄え、衝撃を与えることで必要な時に熱を取り出せる。
一方で常時安定して高い温度を供給することを求められる暖房用の蓄熱装置としては好ましくない。
核生成剤を添加することで過冷却を抑制できる。[16][17]
能動的には、超音波や電圧印加で過冷却を解除できる。[18]
ちなみに、厳密に言えば酢酸ナトリウムの過冷却は水に本来の溶解度を超えて酢酸ナトリウムが溶けている過飽和現象である。水のような単体の過冷却とは仕組みが異なる。[19]約60%より濃度が低い酢酸ナトリウム溶液で過冷却が破れた場合、液体の飽和溶液と固体の酢酸ナトリウム三水和物結晶にわかれる。(相分離)[17]
合成・反応
合成
「酢酸ナトリウム」の例文・使い方・用例・文例
- 酢酸ナトリウムという化合物
酢酸・ナトリウムと同じ種類の言葉
- 酢酸・ナトリウムのページへのリンク