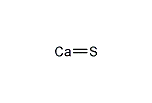りゅうか‐カルシウム〔リウクワ‐〕【硫化カルシウム】
硫化カルシウム
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/08/04 13:55 UTC 版)
| 硫化カルシウム | |
|---|---|
 |
|
|
Calcium sulfide |
|
|
別称
Calcium monosulfide,
Hepar calcies, Sulfurated lime Oldhamite |
|
| 識別情報 | |
|
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.039.869 |
| EC番号 |
|
| KEGG | |
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| 特性 | |
| 化学式 | CaS |
| モル質量 | 72.143 g/mol |
| 外観 | 白色の結晶、吸湿性 |
| 密度 | 2.59 g/cm3 |
| 融点 | 2525 °C, 2798 K, 4577 °F |
| 水への溶解度 | 加水分解 |
| 溶解度 | エタノールに溶けない 酸と反応する |
| 屈折率 (nD) | 2.137 |
| 構造 | |
| ハライト(立方晶系、面心立方格子構造)、cF8 | |
| Fm3m, No. 225 | |
|
a = 569.08 nm[1]
|
|
| 八面体 (Ca2+); 八面体 (S2−) | |
| 危険性 | |
| 労働安全衛生 (OHS/OSH): | |
|
主な危険性
|
水と反応してH2Sを放出 |
| GHS表示: | |
   |
|
| Warning | |
| H315, H319, H335, H400 | |
| P261, P273, P305+P351+P338 | |
| NFPA 704(ファイア・ダイアモンド) | |
| 関連する物質 | |
| その他の 陰イオン |
酸化カルシウム |
| その他の 陽イオン |
|
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
硫化カルシウム(りゅうかカルシウム、英:Calcium sulfide、化学式:CaS)はカルシウムの硫化物である。 白色であり、岩塩のように立方体の結晶を作る。 硫化カルシウムは排ガスの脱硫処理で生成する石膏をリサイクルするプロセスでの生成物として研究されて来た。 他の多くの硫化物イオンを含む塩のように、硫化カルシウムは硫化水素の臭気を持つ。 これは塩の加水分解により硫化水素が発生することによる。 冷水に難溶性。
生成法
硫化カルシウムは、より一般的なカルシウム化合物である硫酸カルシウムの炭素還元反応、つまり、硫酸カルシウムと炭素の混合物を、空気を絶って900℃に熱することにより生成する。
硫化カルシウムは硫酸カルシウムとさらに以下のとおり反応する[2]。
この反応は、主に廃石膏をリサイクルして生石灰を得るために用いられる。
反応性
硫化カルシウムは湿気があるとその水分とさまざまな比率で反応し、水硫化カルシウム Ca(SH)2、水酸化カルシウム 、 の混合物を生成する。
Ca(SH)(OH)はさらに水と反応して水酸化カルシウムと硫化水素を生じる。硫化水素は腐った卵のような不快な臭いの原因物質である。
水酸化カルシウムの飽和溶液は単体硫黄と反応して石灰硫黄合剤を生成する。これは殺虫剤として使われてきた。活性を持つ成分はおそらく硫化カルシウムではなく五硫化カルシウムである[3]。
脚注
- ^ “ChemicalBook”. 2025年7月7日閲覧。
- ^ “硫酸カルシウムの還元熱分解による硫化カルシウム生成特性”. 2024年11月6日閲覧。
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
関連項目
硫化カルシウムと同じ種類の言葉
- 硫化カルシウムのページへのリンク