炭酸アンモニウム
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2024/01/12 16:04 UTC 版)
| 炭酸アンモニウム | |
|---|---|
| |
| IUPAC名 | Ammonium carbonate |
| 別名 | 炭安、鹿角塩 |
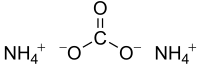
| 組成式 | (NH4)2CO3 |
| 式量 | 96.09 g/mol |
| 形状 | 無色または白色の固体 |
| CAS登録番号 | 506-87-6 |
| 密度と相 | 1.50 g/cm3, 固体 |
| 水への溶解度 | 可溶 g/100 mL ( °C) |
| 融点 | 58 °C(分解) |
性質
無色の結晶または白色の粉末で、強いアンモニア臭を持つ。
58 ℃ で熱分解し、二酸化炭素(石灰水を入れると白く濁る)とアンモニア(水にぬれた赤色リトマス紙を近づけると青色に変化する)と水(塩化コバルト紙を近づけると青色から赤色に変化する)に変わる。空気中に放置してもゆっくりと二酸化炭素とアンモニアを放出しながら分解し、炭酸水素アンモニウムが残る。水に可溶で、水溶液は塩基性を示す。
合成
炭酸アンモニウムは、窒素を含む有機物質(例:髪の毛、シカの角、尿の分解物など)を乾燥条件で加熱して抽出できる。しかし現在では炭酸アンモニウムは、塩化アンモニウムあるいは硫酸アンモニウムと、白亜(石灰岩: 炭酸カルシウムが主成分)を鉄製の容器の中で赤熱し、出てくる気体を鉛製の受け器で濃縮して作られる。粗生成物から昇華により得られる炭酸アンモニウムの白い繊維状の固まりは、等モルの炭酸水素アンモニウムとカルバミン酸アンモニウムから成る。この混合物は、その組成よりセスキ炭酸アンモニウム (ammonium sesquicarbonate) とも呼ばれる。それをアルコールで蒸解(digestion)したり、空気中に放置したりすると、カルバミン酸アンモニウムが分解し純粋な炭酸水素アンモニウムが得られる。また、約 30 ℃ で調製したセスキ炭酸アンモニウムの濃い水溶液にアンモニアを通じると、上記の混合物とは異なる純粋な炭酸アンモニウム ((NH4)2CO3) が、水和物の結晶として得られる。この化合物もまた空気中でアンモニアを放出し、炭酸水素アンモニウムへと戻る。
用途
炭酸アンモニウムはその刺激臭から、必要なときに砕いて使う気付け薬として用いられる。"baker's ammonia"(パン屋のアンモニア)としても知られ、かつてはふくらし粉の用途に使われていた。
関連項目
- 1 炭酸アンモニウムとは
- 2 炭酸アンモニウムの概要
炭酸アンモニウムと同じ種類の言葉
固有名詞の分類
- 炭酸アンモニウムのページへのリンク