二硝酸銅(II)
硝酸銅(II)
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/10/20 23:35 UTC 版)

|
|

|
|
| 物質名 | |
|---|---|
|
二硝酸銅(II) |
|
| 識別情報 | |
|
|
|
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.019.853 |
|
PubChem CID
|
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| 性質 | |
| Cu(NO3)2 | |
| モル質量 | 187.57 g/mol, 241.60 (Cu(NO3)2.3H2O), 232.59 (Cu(NO3)2.2.5H2O |
| 外観 | 青色の結晶 |
| 密度 | 2.32 g/cm3 (無水物) |
| 融点 | 114.5 °C (三水和物) 210°C 昇華(無水物) |
| 沸点 | 170 °C (分解) |
| 138 g/100 mL (0 °C) 三水和物 | |
| 構造 | |
| 直方晶系(無水物) 菱面体晶(水和物) |
|
| 危険性 | |
| 労働安全衛生 (OHS/OSH): | |
|
主な危険性
|
刺激性、酸化剤 |
| NFPA 704(ファイア・ダイアモンド) | |
| NIOSH(米国の健康曝露限度): | |
|
PEL
|
TWA 1 mg/m3 (as Cu)[1] |
|
REL
|
TWA 1 mg/m3 (as Cu)[1] |
|
IDLH
|
TWA 100 mg/m3 (as Cu)[1] |
| 安全データシート (SDS) | Cu(NO3)2·3H2O |
| 関連する物質 | |
| 関連物質 | CuSO4, 硫酸銅(II) |
|
特記無き場合、データは標準状態 (25 °C [77 °F], 100 kPa) におけるものである。
|
|
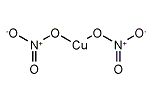
硝酸銅(II)(しょうさんどう(II)、Copper(II) nitrate)は、化学式がCu(NO3)2の無機化合物である。単に硝酸銅といえばこの硝酸銅(II)を指す。無水物の外見は青色の結晶。水和物も青色で、学校などでダニエル電池の演示実験に用いられる。
構造と性質
無水物と水和物の違いは結晶水の効果によって説明される。
無水物
鮮やかな青色の揮発性の固体で、真空中では昇華する。気相ではCu中心が4個の酸素原子に囲まれた平面四角形構造をとり、凝縮させるとポリマー化する[2]。
 
|
|
|
水和物
Cu(NO3)2(H2O)2.5はCu中心が水と硝酸イオンに囲まれた正八面体構造をとる[2]。この水和物は約170℃で酸化銅(II)と二酸化窒素と酸素に分解する。
合成と反応
Cu(NO3)2は金属銅を四酸化二窒素で処理することによって得られる[4]。
水和物は無水物の加水分解か、金属銅を硝酸銀水溶液または希硝酸で処理することによって得られる。
硝酸銅を熱することによって発生した気体を水に通すことによって硝酸が生成する。これはオストワルト法の最終段階に似ている。
脚注
- ^ a b c NIOSH Pocket Guide to Chemical Hazards 0150
- ^ a b Wells, A.F. Structural Inorganic Chemistry, Oxford: Clarendon Press (1984). ISBN 0-19-855370-6.
- ^ Greenwood, Norman N. [英語版]; Earnshaw, Alan (1997). Chemistry of the Elements (英語) (2nd ed.). Butterworth-Heinemann. doi:10.1016/C2009-0-30414-6. ISBN 978-0-08-037941-8.
- ^ Jolly, W. L. "The Synthesis and Characterization of Inorganic Compounds" Prentice Hall, London, 1970
外部リンク
- 硝酸銅(II)のページへのリンク



![{\displaystyle {2\,\mathrm {Cu} (\mathrm {NO} {\vphantom {A}}_{\smash[{t}]{3}}){\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}2\,\mathrm {CuO} \ {}+{}4\,\mathrm {NO} {\vphantom {A}}_{\smash[{t}]{2}}\ {}+{}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7d543864d58a44e9df776f7302c6f362577f90f9)
![{\displaystyle {\mathrm {Cu} \ {}+{}2\,\mathrm {N} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{4}}{}\mathrel {\longrightarrow } {}\mathrm {Cu} (\mathrm {NO} {\vphantom {A}}_{\smash[{t}]{3}}){\vphantom {A}}_{\smash[{t}]{2}}\ {}+{}2\,\mathrm {NO} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/16d01e32c4a8d554d84d16e345c0a8416bd9e20b)
![{\displaystyle {\mathrm {Cu} \ {}+{}4\,\mathrm {HNO} {\vphantom {A}}_{\smash[{t}]{3}}{}\mathrel {\longrightarrow } {}\mathrm {Cu} (\mathrm {NO} {\vphantom {A}}_{\smash[{t}]{3}}){\vphantom {A}}_{\smash[{t}]{2}}\ {}+{}2\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} \ {}+{}2\,\mathrm {NO} {\vphantom {A}}_{\smash[{t}]{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dd118a7636013a794069528bef5de2d5387426ab)
![{\displaystyle {3\,\mathrm {NO} {\vphantom {A}}_{\smash[{t}]{2}}\ {}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}2\,\mathrm {HNO} {\vphantom {A}}_{\smash[{t}]{3}}\ {}+{}\mathrm {NO} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/927d55f6be5b21bc9058feedea13a162a50f9cd3)
