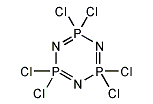
ヘキサクロロシクロトリホスファゼン
| 分子式: | Cl6N3P3 |
| その他の名称: | Hexachlorocyclotriphosphazene、Cyclic phosphonitrilic chloride trimer、ヘキサクロロシクロトリホスファゼン、環状ホスホニトリル酸クロリド三量体、2,2,4,4,6,6-Hexahydro-2,2,4,4,6,6-hexachloro-1,3,5,2,4,6-triazatriphosphorine、ヘキサクロロトリホスホニトリル、ヘキサクロロシクロホスファザトリエン、ヘキサクロロホスファゼン、ホスニック390、Hexachlorotriphosphonitrile、Hexachlorocyclophosphazatriene、Hexachlorotriphosphazene、Hexachlorophosphazene、Phosnic 390、2,2,4,4,6,6-Hexachloro-2,4,6-triphospha(V)-1,3,5-triazine、2,2,4,4,6,6-Hexachloro-2,4,6-triphospha-1,3,5-triazine、2,2,4,4,6,6-Hexachloro-1,3,5-triaza-2,4,6-triphospha(V)-1,3,5-cyclohexatriene、2,2,4,4,6,6-Hexachloro-1,3,5,2,4,6-triazatriphosphorine、Hexachloro-1,3,5,2,4,6-triazatriphosphorine、2,2,4,4,6,6-Hexachloro-1,3,5-triaza-2,4,6-triphospha(V)benzene |
| 体系名: | 2,2,4,4,6,6-ヘキサクロロ-1,3,5,2,4,6-トリアザトリホスホリン、2,2,4,4,6,6-ヘキサヒドロ-2,2,4,4,6,6-ヘキサクロロ-1,3,5,2,4,6-トリアザトリホスホリン、2,2,4,4,6,6-ヘキサクロロ-2,4,6-トリホスファ(V)-1,3,5-トリアジン、2,2,4,4,6,6-ヘキサクロロ-2,4,6-トリホスファ-1,3,5-トリアジン、2,2,4,4,6,6-ヘキサクロロ-1,3,5-トリアザ-2,4,6-トリホスファ(V)-1,3,5-シクロヘキサトリエン、ヘキサクロロ-1,3,5,2,4,6-トリアザトリホスホリン、2,2,4,4,6,6-ヘキサクロロ-1,3,5-トリアザ-2,4,6-トリホスファ(V)ベンゼン |
ヘキサクロロシクロトリホスファゼン
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/10/22 08:39 UTC 版)

|
|

|
|
| 物質名 | |
|---|---|
|
2,2,4,4,6,6-Hexachloro-1,3,5,2λ5,4λ5,6λ5-triazatriphosphinine |
|
|
別名
|
|
| 識別情報 | |
|
3D model (JSmol)
|
|
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.012.160 |
| EC番号 |
|
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| 性質 | |
| (NPCl 2) 3 |
|
| モル質量 | 347.64 g·mol−1 |
| 外観 | 白色の結晶ないし粉末[1] |
| 密度 | 1.98 g/mL at 25 °C |
| 融点 | 112 - 114 °C (234 - 237 °F; 385 - 387 K) |
| 沸点 | 分解 ( 167 °C 以上) |
| 60 °C at 0.05 Torr | |
| 分解 | |
| 四塩化炭素への溶解度 |
|
| シクロヘキサンへの溶解度 |
|
| キシレンへの溶解度 |
|
| 磁化率 | −149×10−6 cm3/mol |
| 屈折率 (nD) | 1.62 (589 nm) |
| 構造 | |
| 直方晶系 | |
| 62 (Pnma, D16 2h) |
|
| D3h | |
|
a = 13.87 Å, b = 12.83 Å, c = 6.09 Å
|
|
|
式単位 (Z)
|
4 |
| いす型 | |
| 0 D | |
| 熱化学 | |
|
標準生成熱 (ΔfH⦵298)
|
−812.4 kJ/mol |
|
蒸発熱 (ΔfHvap)
|
55.2 kJ/mol |
|
昇華熱 (ΔfHsublim)
|
76.2 kJ/mol |
| 危険性 | |
| 労働安全衛生 (OHS/OSH): | |
|
主な危険性
|
中程度の刺激性 |
| GHS表示: | |
 |
|
| Danger | |
| H314 | |
| P260, P264, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P405, P501 | |
| 引火点 | 不燃性 |
| 関連する物質 | |
| 関連するハロゲン化環式ホスファゼン | ヘキサフルオロシクロトリホスファゼン ヘキサブロモシクロトリホスファゼン |
|
特記無き場合、データは標準状態 (25 °C [77 °F], 100 kPa) におけるものである。
|
|
ヘキサクロロシクロトリホスファゼン(英: Hexachlorocyclotriphosphazene)は、化学式(NPCl2)3で表される、リンと窒素と塩素からなる無機化合物である。
歴史
1834年にユストゥス・フォン・リービッヒが五塩化リン(PCl5)と塩化アンモニウム(NH4Cl)から合成し[2]、その後H.N.Stokesが六員環化合物であることを提案。1943年にL.O.BrockwayとW.M.Brightが電子回折、1958年にA.WilsonとD.F.CarrollがにX線回折で調べ、構造が確認された[3]。
分子構造
リンと窒素からなる六員環のリン原子に、塩素原子が二つずつ結合した構造である。リン原子と窒素原子間の結合長はほぼ等しく、∠PNPと∠NPNの結合角は前者がわずかに広い。リン原子と窒素原子はほぼ同一平面上に位置するが、塩素原子は同一平面上には位置していない[4]。
製造
日本では2011年現在大塚化学と伏見製薬所が製造しており、かつては日本化学工業、日本精化、新日曹化工でも生産を行っていた[3]。
(NPCl2)3の合成方法は様々な経路が研究されており、PCl5とNH4Clの反応、白リンと窒素とアンモニアの反応が一般的である。三塩化リンとアンモニアから直接合成することはできない[5]。工業的にはPCl5とNH4Clをクロロベンゼン或いはトリクロロエタン溶媒中で反応させて生産される[6]。
- nPCl5 + nNH4Cl = (NPCl2)n + Cl(NPCl2)3nPCl4 + 4nHCl
用途
(NPCl2)3をそのまま利用することはなく、塩素を有機基で置換した誘導体の形での利用が行われている。
アルコキシホスファゼンがレーヨンに、ジアミノテトラクロロシクロトリホスファゼンまたはジアミノテトラフェノキシシクロトリホスファゼンがポリウレタンに難燃性をもたらすことが報告されており、化学繊維や合成樹脂、綿などへの難燃剤や防炎剤として利用される[7]。
塩素をフェニル基あるいはナフタレン基で置換した誘導体は、高温域でも潤滑性能を有する[8]。ナノメートル単位の厚さで塗布したホスファゼン誘導体はハードディスクドライブ用潤滑剤として利用される[9]。
重合体
(NPCl2)3を密閉状態で250~350℃に加熱すると重合し、ゴム状の重合体 (NPCl2)n を形成する。これは直鎖状と枝分かれした重合体の混合物である。直鎖状重合体はベンゼン、トルエン、テトラヒドロフランに可溶であるが、分枝状重合体はこれらの溶媒に不溶である[10]。重合体を急激に加熱すると解重合し、再び環状の(NPCl2)3となる[11]。重合体を大気中に放置すると水分と反応し、徐々に加水分解する。この過程で弾性を失い、最終的にはリン酸とアンモニア、塩化水素を生じる[12]。
脚注
参考文献
- 梶原鳴雪『ホスファゼン科学の基礎(普及版)』シーエムシー出版、2002年3月27日。ISBN 978-4-88231-755-5。
- 梶原鳴雪「ホスファゼン化合物の用途開発, 新展開及び将来展望」(PDF)『CREATIVE』第10巻、日本化学工業、2011年、2019年5月10日閲覧。
- ヘキサクロロシクロトリホスファゼンのページへのリンク