しゅう酸
シュウ酸
(エタン二酸 から転送)
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/10/06 10:23 UTC 版)

|
この記事は検証可能な参考文献や出典が全く示されていないか、不十分です。 (2021年5月)
|

|
|||
|
|||

Oxalic acid dihydrate
|
|||
| 物質名 | |||
|---|---|---|---|
|
1,2-ethanedioic acid |
|||
|
別名
|
|||
| 識別情報 | |||
| JGlobalID |
|
||
|
3D model (JSmol)
|
|||
| バイルシュタイン | 385686 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.005.123 | ||
| EC番号 |
|
||
| Gmelin参照 | 2208 | ||
| KEGG | |||
| MeSH | Oxalic+acid | ||
|
PubChem CID
|
|||
| RTECS number |
|
||
|
日化辞番号
|
|
||
| UNII |
|
||
| 国連/北米番号 | 3261 | ||
|
CompTox Dashboard (EPA)
|
|||
|
|
|||
|
|||
| 性質 | |||
| C2H2O4 | |||
| モル質量 |
|
||
| 外観 | 白色の結晶 | ||
| 匂い | 無臭 | ||
| 密度 |
|
||
| 融点 |
|
||
|
|||
| エタノールへの溶解度 | 237 g/L @ 15 °C (59 °F)[4] | ||
| ジエチルエーテルへの溶解度 | 14 g/L @ 15 °C (59 °F)[4] | ||
| 蒸気圧 |
|
||
| 酸解離定数 pKa | 1.25 and 4.28[6] | ||
| 磁化率 | −60.05×10−6 cm3/mol | ||
| 熱化学[7] | |||
| 標準定圧モル比熱, Cp |
91.0 J/(mol·K) | ||
| 標準モルエントロピー S |
109.8 J/(mol·K) | ||
|
標準生成熱 (ΔfH⦵298)
|
−829.9 kJ/mol | ||
| 薬理学 | |||
| QP53AG03 (WHO) | |||
| 危険性 | |||
| 労働安全衛生 (OHS/OSH): | |||
|
主な危険性
|
腐食性 | ||
| GHS表示: | |||
   |
|||
| Danger | |||
| H302+H312, H318, H402 | |||
| P264, P270, P273, P280, P301+P312+P330, P302+P352+P312, P305+P351+P338+P310, P362+P364, P501 | |||
| NFPA 704(ファイア・ダイアモンド) | |||
| 引火点 | 166 °C (331 °F; 439 K) | ||
| 致死量または濃度 (LD, LC) | |||
|
LDLo (最小致死量)
|
|
||
| NIOSH(米国の健康曝露限度):NIOSH Pocket Guide to Chemical Hazards 0474 | |||
|
PEL
|
TWA 1 mg/m3 | ||
|
REL
|
|
||
|
IDLH
|
500 mg/m3 | ||
| 安全データシート (SDS) | External MSDS | ||
| 関連する物質 | |||
| 関連するカルボン酸 | ギ酸; マロン酸 | ||
| 関連物質 | グリオキサール; グリオキシル酸; グリコール酸; グリコールアルデヒド; エチレングリコール | ||
|
特記無き場合、データは標準状態 (25 °C [77 °F], 100 kPa) におけるものである。
|
|||
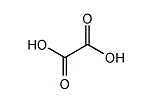
シュウ酸(シュウさん、蓚酸、英: oxalic acid)は、構造式 HOOC–COOH で表される、もっとも単純なジカルボン酸。二つのカルボキシ基を背中合わせに結合した分子である。IUPAC命名法ではエタン二酸(「二」はカタカナの「ニ」ではなく漢数字の「二」) (ethanedioic acid)。1776年、カール・ヴィルヘルム・シェーレがカタバミ(oxalis)から初めて単離したことから命名された。
植物に多く含まれ、和名の由来になっている。漢字の「蓚」はタデ科のスイバを意味し、また中国語でも植物由来の「草酸」と呼ぶ。
カルシウムイオンと強く結合する性質(劇性)があり、体内に入るとアシドーシスに傾いた血液中でカルシウムと結合して結石などを生じる。このため、日本においては毒物及び劇物取締法によって劇物(毒物ではない)に指定されている。
還元性があるため、滴定によく使われる。また、染料原料や漂白剤としても用いられる。
製法
工業的には、木片をアルカリ処理したのち、抽出することで得られる[8]。実験的には、ギ酸ナトリウムを加熱分解して生成するシュウ酸ナトリウムを、水酸化カルシウムによってシュウ酸カルシウムとして単離し、これを硫酸で分解することで得られる[8]。
-

シュウ酸イオン シュウ酸の第一段階解離により生成するシュウ酸水素イオン (hydrogenoxalate, HC2O−
4、H(COO)−
2) は1価の陰イオンであり、第二段階解離により生成するシュウ酸イオン (oxalate, C2O2−
4、(COO)2−
2) は2価の陰イオンである。シュウ酸イオンは平面型で炭素-炭素間は単結合、炭素-酸素間は共鳴し単結合および二重結合の中間的な性格を持つ。シュウ酸塩
シュウ酸イオンを含むイオン結晶である正塩、シュウ酸塩 (oxalate) と、シュウ酸水素イオンを含む酸性塩であるシュウ酸水素塩 (hydrogenoxalate) が存在する。正塩はアルカリ金属塩およびアンモニウム塩、アルミニウム塩および鉄(III)塩は水に可溶性であるが、アルカリ土類金属塩を始めとする多くのものが難溶性である。鉄(III)塩の水溶液は徐々に分解しシュウ酸鉄(II) FeC2O4 を析出し、銀塩は加熱により爆発的に分解する。
- エタン二酸のページへのリンク