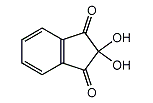
ニンヒドリン
| 分子式: | C9H6O4 |
| その他の名称: | ニンヒドリン、Ninhydrin、トリケトヒドリンデン水和物、Triketohydrindene hydrate、2,2-Dihydroxy-1H-indene-1,3(2H)-dione、2,2-Dihydroxy-1,3-indanedione、2,2-Dihydroxyindane-1,3-dione、1,2,3-トリケトヒドリンデンヒドラート、1,2,3-インダントリオンヒドラート、1,2,3-Triketohydrindene hydrate、1,2,3-Indantrione hydrate、2,2-Dihydroxy-2,3-dihydro-1H-indene-1,3-dione |
| 体系名: | 2,2-ジヒドロキシ-1,3-インダンジオン、2,2-ジヒドロキシインダン-1,3-ジオン、2,2-ジヒドロキシ-1H-インデン-1,3(2H)-ジオン、2,2-ジヒドロキシ-2,3-ジヒドロ-1H-インデン-1,3-ジオン |
ニンヒドリン
2,2-ジヒドロキシインダン-1,3-ジオン。皮膚や粘液に有毒な化合物。ペプチド結合の化学検出に使われる。(タンパク質の検出・同定、放射性ラベルの分析)
| Name | Ninhydrin 1) |
|---|---|
| MeSH | 68009555 |
| 別名 | 1,2,3-インダントリオンモノヒドラート |
| 分子式 | C9H6O4 |
| 分子量 | 178.15 g/mol |
| CAS登録番号 | 485-47-2 |
| 形状 | 淡黄色固体 |
| 融点 | 241 ℃(分解) |
| 安全性 | 0766 |
ニンヒドリン反応
ニンヒドリンとアミノ酸の反応により、ニンヒドリンが還元されアミノ酸はアルデヒドに変化し、アンモニアと二酸化炭素が発生する。

続いて、還元ニンヒドリンとニンヒドリンがアンモニアを介して縮合し、ルーヘマン紫と水が生成する。


CC Attribution-Noncommercial-Share Alike 3.0 Unported
ニンヒドリン
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2024/10/07 15:00 UTC 版)
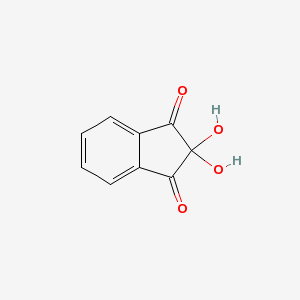
| ニンヒドリン | |
|---|---|
 |
|
 |
|
|
2,2-Dihydroxy-1H-indene-1,3(2H)-dione
|
|
|
別称
2,2-Dihydroxyindane-1,3-dione
1,2,3-Indantrione hydrate |
|
| 識別情報 | |
| CAS登録番号 | 485-47-2  |
| PubChem | 10236 |
| ChemSpider | 9819  |
| UNII | HCL6S9K23A  |
| EC番号 | 213-340-1 |
| ChEMBL | CHEMBL1221925  |
|
|
|
|
| 特性 | |
| 化学式 | C9H6O4 |
| モル質量 | 178.14 g mol−1 |
| 外観 | 白色の固体 |
| 密度 | 0.862 g/cm3 |
| 融点 | 250℃ (分解) |
| 水への溶解度 | 20 g L−1[1] |
| 危険性 | |
| 安全データシート(外部リンク) | External MSDS |
| GHSピクトグラム |  |
| GHSシグナルワード | 警告(WARNING) |
| Hフレーズ | H302, H315, H319, H335 |
| Pフレーズ | P261, P264, P270, P271, P280, P301+312, P302+352, P304+340, P305+351+338, P312, P321, P330, P332+313, P337+313 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
ニンヒドリン (ninhydrin) は芳香族化合物の一種で、1,2,3-インダントリオンモノヒドラート、2,2-ジヒドロキシインダン-1,3-ジオンとも呼ばれる。化学式は C9H6O4 で、分子量 178.15、CAS登録番号は [485-47-2]。刺激物であり、常温で淡黄色固体。水、アルコールに可溶。アミノ酸の検出反応であるニンヒドリン反応に用いられることで知られる。皮膚などに触れると炎症を起こす。
ニンヒドリン反応
ニンヒドリン反応 (ninhydrin reaction) は、ニンヒドリン水溶液と α-アミノ酸によって起きる呈色反応で、アブデルハルデン反応 (Abderhalden reaction) とも呼ばれる。タンパク質やペプチドなどの検出に利用される。α-アミノ酸と2分子のニンヒドリンが反応し、共役系化合物であるルーエマン紫 (Ruhemann's purple) という青紫色の色素とアルデヒドが生成する。 ただしプロリンに関しては別で、このアミノ酸は一般の α-アミノ酸と異なり、ニンヒドリン1分子としか反応せず、ルーエマン紫とは異なる黄色を呈する共役系化合物を生成して反応が終結する。
この反応は多方面に応用されており、ニンヒドリンのアセトン溶液は指紋検出に使われ、また、この反応を用いてスタンフォード・ムーアとウィリアム・スタインはタンパク質のアミノ酸を分析している。
反応機構
反応には2分子のニンヒドリンが関与する。

ニンヒドリンの2位の炭素の2つのヒドロキシ基は容易に脱水し、カルボニル基となる。そのカルボニル基にα-アミノ酸のアミノ基が求核攻撃し、脱水、脱炭酸、加水分解を経ることで、ニンヒドリンの2位の炭素の2つのヒドロキシ基が水素とアミノ基に置換された化合物とアルデヒドが生成する。(なお、プロリンなどα-アミノ酸でないアミノ酸の場合は加水分解できず、脱炭酸の段階で反応が終結する。加水分解ができないためアルデヒドは生成しない。生じた化合物は共役系の構造をもつため発色するが、ルーエマン紫(Ruhemann's purple)とは異なる色素である。)
続いて、2分子目のニンヒドリンの2位のカルボニル基に、1分子目のニンヒドリンに結合したアミノ基が求核攻撃し、脱水することで、共役系の構造を持つ色素であるルーエマン紫が生成する。
出典
- ^ Chemicals and reagents, 2008–2010, Merck
関連項目
ニンヒドリンと同じ種類の言葉
固有名詞の分類
- ニンヒドリンのページへのリンク