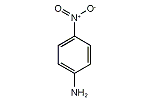
4‐ニトロアニリン
| 分子式: | C6H6N2O2 |
| その他の名称: | 4-Nitroaniline、p-Nitroaniline、p-Nitraniline、4-Nitrobenzenamine、C.I.37035、C.I.Azoic Diazo Component 37(base)、デベロッパーP、ファーストレッドベース2J、ファーストレッドPベース、ファーストレッドベースGG、アゾイックDC37(ベース)、C.I.デベロッパー17、C.I.アゾイックジアゾコンポーネント37(ベース)、ファーストレッド2Gベース、Developer P、Fast Red Base 2J、Fast Red P Base、Fast Red Base GG、C.I.37035(base)、C.I.Developer 17、Fast Red 2G Base、Azoic DC 37(base)、(4-Nitrophenyl)amine、N-Oxylato-N-oxo-4-aminophenylaminium、1-Amino-4-nitrobenzene、1-Nitro-4-aminobenzene、4-Nitro-1-benzenamine、4-Nitrophenylamine、4-Nitrobenzen-1-amine |
| 体系名: | 4-ニトロベンゼン-1-アミン、4-ニトロフェニルアミン、1-ニトロ-4-アミノベンゼン、1-アミノ-4-ニトロベンゼン、4-ニトロ-1-ベンゼンアミン、4-ニトロベンゼンアミン、p-ニトロアニリン、4-ニトロアニリン、(4-ニトロフェニル)アミン、N-オキシラト-N-オキソ-4-アミノフェニルアミニウム |
4-ニトロアニリン
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/08/22 22:39 UTC 版)
| 4-ニトロアニリン | |
|---|---|
 |
 |
 |
|
|
4-Nitroaniline
|
|
|
4-Nitrobenzenamine
|
|
|
別称
p-Nitroaniline
1-Amino-4-nitrobenzene p-Nitrophenylamine |
|
| 識別情報 | |
|
3D model (JSmol)
|
|
| バイルシュタイン | 508690 |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.002.555 |
| EC番号 |
|
| Gmelin参照 | 27331 |
| KEGG | |
|
PubChem CID
|
|
| RTECS number |
|
| UNII | |
| 国連/北米番号 | 1661 |
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| 特性 | |
| 化学式 | C6H6N2O2 |
| モル質量 | 138.12 g/mol |
| 外観 | 黄色または褐色の粉末 |
| 匂い | わずかにアンモニア臭 |
| 密度 | 1.437 g/ml, 固体 |
| 融点 | 146 - 149 °C (文献値) |
| 沸点 | 332 °C |
| 水への溶解度 | 0.8 mg/ml at 18.5 °C (IPCS) |
| 蒸気圧 | 0.00002 mmHg (20°C)[1] |
| 磁化率 | −66.43·10−6 cm3/mol |
| 危険性 | |
| 労働安全衛生 (OHS/OSH): | |
|
主な危険性
|
Toxic |
| GHS表示: | |
  |
|
| Warning | |
| H301, H311, H331, H373, H412 | |
| P260, P261, P264, P270, P271, P273, P280, P301+P310, P302+P352, P304+P340, P311, P312, P314, P321, P322, P330, P361, P363, P403+P233, P405, P501 | |
| NFPA 704(ファイア・ダイアモンド) | |
| 引火点 | 199 °C (390 °F; 472 K) |
| 致死量または濃度 (LD, LC) | |
|
半数致死量 LD50
|
3249 mg/kg (ラット, 経口) 750 mg/kg (ラット, 経口) 450 mg/kg (モルモット, 経口) 810 mg/kg (マウス, 経口)[2] |
| NIOSH(米国の健康曝露限度): | |
|
PEL
|
TWA 6 mg/m3 (1 ppm) [skin][1] |
|
REL
|
TWA 3 mg/m3 [skin][1] |
|
IDLH
|
300 mg/m3[1] |
| 安全データシート (SDS) | JT Baker |
| 関連する物質 | |
| 関連物質 | 2-ニトロアニリン 3-ニトロアニリン |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
4-ニトロアニリン (4-nitroaniline) 、または p-ニトロアニリン(パラニトロアニリン、p-nitroaniline) は、有機化合物のひとつで、ベンゼンのパラ位の水素がアミノ基とニトロ基が置き換わった構造を持つ。色素や医薬品合成の中間体、酸化防止剤、ガソリンのガム状化防止剤、家禽の医薬品、腐食防止剤としての用途がある。
合成
下に 4-ニトロアニリンをアニリンから得る合成経路を示す。鍵となる段階はアニリン (1) からアセチル保護したアセトアニリド (2) のアミノ基のパラ位を、混酸によりニトロ化する芳香族求核置換反応である。このとき少量生じる副生物の 2-ニトロアセトアニリド (3a) を精製で除去し 4-ニトロアセトアニリド (3b) を得て、引き続きアセチル基を加水分解で脱保護して 4-ニトロアニリン (4b) を得る[3]。
アニリンを直接ニトロ化しようとすると酸化による分解やアニリニウム塩形成による配向性の変化が起こる。これを防ぐためにアセチル保護が施される。
用途
4-ニトロアニリンは最初のアゾ色素として知られるパラレッドを合成する原料となる[4]。
毒性
4-ニトロアニリンは被曝、誤飲、吸収によって毒性を示すため、取り扱いには注意を要する。ラットにおける半数致死量 (LD50、経口) は 750 mg/kg とする報告がある。強い甘味があるため第二次世界大戦後の混乱期には砂糖の代用品として使用され、多くの中毒者を生んだ。応急処置にはブドウ糖やビタミンC、メチレンブルーの静脈注射が有効である[5]。特に水生生物にとって危険であり、汚染物質として洩れた場合に長期にわたる影響を残す可能性がある。
出典
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards 0449
- ^ “p-Nitroaniline”. 生活や健康に直接的な危険性がある. アメリカ国立労働安全衛生研究所(NIOSH). 2025年8月23日閲覧。
- ^ Mohrig, J. R.; Morrill, T. C.; Hammond, C. N.; Neckers, D. C. "Synthesis 5: Synthesis of the Dye Para Red from Aniline." Experimental Organic Chemistry. Freeman: New York, NY, 1997; pp 456-467.
- ^ Williamson, K. L. Macroscale and Microscale Organic Experiments, Fourth Edition. Houghton-Mifflin, 2002. ISBN 0-618-19702-8
- ^ 『窒素酸化物の事典』p379
参考文献
- 鈴木仁美『窒素酸化物の事典』丸善、2008年。 ISBN 978-4-621-08048-1。
関連項目
4‐ニトロアニリンと同じ種類の言葉
固有名詞の分類
- 4‐ニトロアニリンのページへのリンク