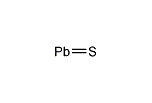P‐128
硫化鉛(II)
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/10/27 08:19 UTC 版)

|
|

|
|
| 物質名 | |
|---|---|
|
別名
Plumbous sulfide |
|
| 識別情報 | |
|
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.013.861 |
| EC番号 |
|
|
PubChem CID
|
|
| RTECS number |
|
| UNII | |
| 国連/北米番号 | 3077 |
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| 性質 | |
| PbS | |
| モル質量 | 239.30 g/mol |
| 密度 | 7.60 g/cm3[1] |
| 融点 | 1,113[1] °C (2,035 °F; 1,386 K) |
| 沸点 | 1,281 °C (2,338 °F; 1,554 K) |
| 2.6×10−11 kg/kg (計算値, pH=7)[2] 8.6×10−7 kg/kg[3] | |
| 溶解度平衡 Ksp | 9.04×10−29 |
| 磁化率 | −83.6·10−6 cm3/mol[4] |
| 屈折率 (nD) | 3.91[5] |
| 構造[7] | |
| 塩化ナトリウム型(立方晶), cF8 | |
| Fm3m, No. 225 | |
|
a = 5.936 Å
|
|
|
式単位 (Z)
|
4 |
| 正八面体型 (Pb2+) 正八面体型 (S2−) |
|
| 3.59 D[6] | |
| 熱化学[8] | |
| 標準定圧モル比熱, Cp⦵ | 49.5 J/mol⋅K |
| 標準モルエントロピー S⦵ | 91.2 J/mol |
|
標準生成熱 (ΔfH⦵298)
|
−100.4 kJ/mol |
|
ギブズの 自由エネルギー (ΔfG⦵) |
−98.7 kJ/mol |
| 危険性 | |
| GHS表示: | |
   |
|
| Danger | |
| H302, H332, H360, H373, H410 | |
| P201, P202, P260, P261, P264, P270, P271, P273, P281, P301+P312, P304+P312, P304+P340, P308+P313, P312, P314, P330, P391, P405, P501 | |
| NFPA 704(ファイア・ダイアモンド) | |
| 引火点 | 不燃性 |
| 安全データシート (SDS) | External MSDS |
| 関連する物質 | |
| その他の 陰イオン |
酸化鉛(II) セレン化鉛(II) テルル化鉛(II) |
| その他の 陽イオン |
一硫化炭素 一硫化ケイ素 硫化ゲルマニウム(II) 硫化スズ(II) |
| 関連物質 | 硫化タリウム 硫化鉛(IV) 硫化ビスマス |
|
特記無き場合、データは標準状態 (25 °C [77 °F], 100 kPa) におけるものである。
|
|
硫化鉛(II)(りゅうかなまり に、英: lead(II) sulfide)は、化学式PbSをもつ無機化合物である。方鉛鉱とも呼ばれる基礎的な鉱物で、鉛の最も重要な化合物である。半導体として特殊用途に用いられる。
基本的性質・合成・関連物質
硫化水素または硫化物を鉛イオンの水溶液に加えると、黒色の沈殿として得られる。
- 硫化鉛(II)のページへのリンク