気体
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2024/01/01 02:34 UTC 版)
巨視的性質
気体を観察する場合、基準となる範囲や長さを指定するのが一般的である。基準となる代表長さが気体粒子の平均自由行程より十分に大きい場合(クヌーセン数が十分に小さい場合)、気体は連続体とみなされ巨視的観点から把握される。その場合、体積の面でも十分な量の気体粒子を標本化できる大きさでなければならない。このような大きさで統計的分析を行うことで、その範囲内のあらゆる気体粒子の平均的動き(すなわち、速度、温度、圧力)を観測できる。対照的に微視的、つまり粒子単位の観察を行う方法もある。
巨視的観点で観測される気体の性質には、気体粒子そのものに由来するもの(速度、圧力、温度)とそれらの環境によるもの(体積)がある。例えばロバート・ボイルは一時期、気体化学を研究していた。彼は気体の圧力と体積の関係について巨視的観点で実験を行った。その実験でJの字形の試験管のようなマノメーターを使い、その管の一端に一定粒子数で一定温度の不活性気体を入れ、さらに水銀を入れて密封した。そして、水銀の量を増やして気体にかかる圧力を増すと気体の体積が小さくなることを見出し、数学的には反比例の関係にあることを発見した。つまり、体積と圧力の積が常に一定になることをつきとめた。ボイルは様々な気体でこれが成り立つことを確かめ、ボイルの法則 (PV = 定数) が生まれた。
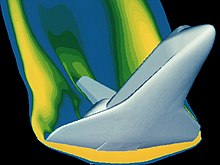
気体物性の分析に使用する様々な数学的ツールがある。理想流体についてはオイラー方程式があるが、極限条件の気体では数学的ツールもやや複雑化し、粘性の効果を完全に考慮したナビエ-ストークス方程式などが使われる[9]。このような方程式は対象とする気体の特定の条件を満たすよう理想化されている。ボイルの実験装置は代数学を使って分析結果を得ることを可能にした。ボイルが結果を得られたのは、彼が扱っていた気体が比較的低圧で「理想」的な振る舞いをする状況だったからである。そういった理想的関係は、一般的な条件の計算には十分である。今日の最先端テクノロジーにおいては、気体が「理想」的な振る舞いをしない条件下での実験を可能とする各種装置も設計されている。統計学や多変量解析といった数学が、宇宙船の大気圏再突入のような複雑な状況の解を求めることを可能にしている。例えば、図にあるようにスペースシャトルの大気圏再突入の際の負荷が材料や構造の限界を超えていないことを確認する分析などがある。そのような状況では、気体は理想的には振る舞わない。
圧力
圧力を表す記号は "p " または "P " を使い、SI単位はパスカル (Pa=N/m2) である。
気体が何らかの容器に入っているとき、気体の圧力は気体が容器表面に及ぼす単位面積当たりの平均的な力に等しい。その容積の中で気体粒子は直線的に運動していて、容器に衝突して力を及ぼしていると考えれば理解しやすい。その衝突の際に気体粒子から容器に与えられた力の分だけ粒子の運動量が変化する。古典力学では、運動量は質量と速度の積と定義されている[10]。衝突に際して、粒子の速度の壁と垂直な成分だけが変化する。壁に平行な方向に進む粒子の運動量は変化しない。したがって、粒子の衝突によって容器表面にかかる力の平均は、気体粒子の衝突による線運動量の変化の平均に他ならない。より正確には、粒子が容器表面に衝突した際の力の垂直成分の合計を表面積で割った値が圧力となる。
温度
温度を表す記号は "T " を使い、SI単位はケルビン (K)である。
気体粒子の速度は、その熱力学温度に比例する。右の動画は、風船内に捕らわれた気体粒子が極低温の窒素に触れることでその速度が遅くなり、風船が縮む様子を示している。任意の物理系の温度はその系(気体)を構成する粒子(原子、分子)の運動と関連している[11]。統計力学では、温度とは粒子内に蓄えられた運動エネルギーの平均を示す測度である。このエネルギーを蓄える方法は、粒子自身の自由度(エネルギーモード)で表される。気体粒子が運動エネルギーを蓄えるのは、衝突によって直線運動、回転運動、振動といった運動エネルギーを得たときである(吸熱過程)。対照的に固体内の分子に熱を加えても振動モードでしかエネルギーを蓄えられず、直線運動や回転運動は結晶構造によって妨げられる。熱せられた気体粒子は粒子同士が一定の割合で衝突することで速度が広範囲に変化しうる。速度の範囲はマクスウェル分布で表される。なお、この分布を想定するということは、その系が熱力学的平衡付近の理想気体だと仮定していることを暗に示している。
比体積

比体積を表す記号は "v " を使い、SI単位はm3/kg である。体積は記号 "V " で表され、SI単位はm3 である。
熱力学解析においては、示強属性と示量属性を扱うのが一般的である。気体の量に依存する属性(質量や体積)を示量属性、気体の量に依存しない属性を示強属性と呼ぶ。比体積は単位質量の気体が占める体積の比であり、あらゆる平衡系の気体にわたって同一であるため示強属性の例である[12]。プロトアクチニウムの原子1000個がある温度と圧力で占める体積は、他の任意の原子1000個が同じ温度と圧力で占める体積と同じである。気体に比べて圧縮性のない固体の鉄を思い浮かべればわかりやすい。右の写真にあるような射出座席はロケットで推進するが、ロケットは質量を保持しつつ膨張するガスを噴射しており、この際に比体積が増加する。気体はそれを取り囲むどのような容器であっても全体を満たす性質があり、体積は示量属性である。
密度
密度は記号 "ρ"(ロー)で表され、SI単位はkg/m3 である。これは、比体積の逆数である。
気体粒子は容器内を自由に動けるため、その質量は一般に密度によって特徴付けられる。密度は質量を体積で割った値である。気体の圧力または体積の一方を一定としたとき、密度は広範囲にわたって変化する。この密度の変化の度合いを圧縮率と呼ぶ。圧力や温度と同様、密度は気体の状態変数の1つであり、任意の過程における密度の変化は熱力学の法則に従う。静止気体においては、密度は容器全体で均一である。つまり密度はスカラー量であり、大きさはあるが方向のない単純な物理量である。気体分子運動論によれば、気体の質量が一定のとき密度は容器の大きさすなわち体積に反比例する。すなわち、質量が一定であれば密度の減少とともに体積が増大する。
注釈
- ^ このような物理特性の例外として、マイケル・ファラデーは1833年、氷に電気伝導性がないことを発見した。詳しくは、John Tyndall's Faraday as a Discoverer (1868), p.45
- ^ このときの温度の上限は 1500 K とされている。詳しくは(John 1984, p. 256)
出典
- ^ a b c 岩波書店『広辞苑』 第6版 「気体」
- ^ a b ブリタニカ百科事典 【気体】
- ^ McPherson & Henderson 1917, pp. 104–10
- ^ American Chemical Society, Faraday Society, Chemical Society (Great Britain)'s The Journal of physical chemistry, Volume 11 (Cornell – 1907), page 137.
- ^ Tanya Zelevinsky (2009). “84Sr—just right for forming a Bose-Einstein condensate”. Physics 2: 94.
- ^ Quantum Gas Microscope Offers Glimpse Of Quirky Ultracold Atoms ScienceDaily 4 November 2009 - ボース=アインシュタイン凝縮についてのリンクを提供
- ^ The Journal of physical chemistry, Volume 11 (Cornell – 1907) pp. 164–5.
- ^ John S. Hutchinson (2008). Concept Development Studies in Chemistry. p. 67
- ^ Anderson 1984, p. 501
- ^ J. Clerk Maxwell (1904). Theory of Heat. Mineola: Dover Publications. pp. 319–20. ISBN 0486417352
- ^ See pages 137–8 of Society (Cornell – 1907).
- ^ Kenneth Wark (1977). Thermodynamics (3 ed.). McGraw-Hill. p. 12. ISBN 0-07-068280-1
- ^ (McPherson & Henderson 1917, pp. 60–61)
- ^ Anderson 1984, pp. 289–291
- ^ Anderson 1984, p. 291
- ^ John 1984, p. 205
- ^ John 1984, pp. 247–56
- ^ McPherson & Henderson 1917, pp. 52–55
- ^ McPherson & Henderson 1917, pp. 55–60
- ^ John P. Millington (1906). John Dalton. pp. 72, 77–78
- ^ Online Etymology Dictionary
- ^
 (英語) The Chemical History of a Candle/Lecture II, ウィキソースより閲覧。
(英語) The Chemical History of a Candle/Lecture II, ウィキソースより閲覧。
気体と同じ種類の言葉
- >> 「気体」を含む用語の索引
- 気体のページへのリンク