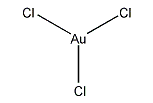
塩化第二金
塩化金(III)
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2021/09/13 09:57 UTC 版)
ナビゲーションに移動 検索に移動| 塩化金(III) | |
|---|---|
 |
|
|
塩化金(III) |
|
|
別称
塩化第二金
|
|
| 識別情報 | |
| CAS登録番号 | 13453-07-1 |
| RTECS番号 | MD5420000 |
| 特性 | |
| 化学式 | AuCl3 |
| モル質量 | 303.325g/mol |
| 外観 | 金色、または黄色の結晶 |
| 密度 | 3.9g/cm3 |
| 融点 | 254 °C, 527 K, 489 °F (分解) |
| 水への溶解度 | 68g/100 ml |
| 構造 | |
| 結晶構造 | 単斜晶 |
| 配位構造 | 平面正方形 |
| 危険性 | |
| 主な危険性 | 刺激性 |
| Rフレーズ | R36/37/38 |
| Sフレーズ | S26 S36 |
| 関連する物質 | |
| その他の陰イオン | フッ化金(III) 臭化金(III) |
| その他の陽イオン | 塩化金(I) 塩化銀(I) 塩化白金(II) 塩化水銀(II) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
塩化金(III)(えんかきん さん、Gold(III) chloride)は、組成式が AuCl3 と表される金と塩素の化合物である。金の化合物として最も一般的である。他の金の塩化物は、塩化金(III)ほど安定ではない。金を王水に溶かすと生じる HAuCl4(塩化金酸)もしばしば「塩化金」などと呼ばれる。
塩化金(III)は非常に吸湿性が強く、水やエタノールに非常によく溶ける。160℃以上、または光によって分解する。
分子構造
塩化金(III)は、固体または低温の気体においては二量体として存在する。臭化金(III)も同じような二量体を形成することが分かっている。それぞれの金原子は平面正方形の中心に位置している。金中心の酸化数と、金属としては高い電気陰性度を反映して、各結合は共有結合性である。
特性
塩化金(III)無水物は160℃あたりで塩化金(I)に分解し始めるが、これはさらに塩化金(III)と金属金に不均化を起こす。
-

同様に、アルキンは三価の金塩の触媒作用によりアミノ化される。
近年、塩化金(III)は芳香族化合物のアルキル化や、フランからフェノール類への変換などを起こす穏やかな酸触媒として有機化学者の研究対象となっている。(以下参照)例えば、アセトニトリルを溶媒として2-メチルフランの5位をメチルエチルケトンへ付加させられる。通常フランやケトンは酸性下で重合などの副反応を起こしやすいが、本反応では高い収率が報告されている。
アルキンが存在すると、フェノール環が生成することがある[8]。
毒性
塩化金(III)は毒物及び劇物取締法により劇物に指定されている[10]。塩化金(III)を吸入すると鼻、のど、気管支の粘膜を刺激する[10]。また皮膚に触れた場合、そのまま放置すると皮膚に赤色の斑点を残す[10]。そして眼に入った場合は粘膜を激しく刺激する[10]。塩化金(III)は他の金化合物(特に無機金塩類)同様人体にとって非常に有害な物質であるといえる。
出典
- ^ N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997
- ^ Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990
- ^ The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960
- ^ H. Nechamkin, The Chemistry of the Elements, McGraw-Hill, New York, 1968
- ^ A. F. Wells, Structural Inorganic Chemistry, 5th ed., Oxford University Press, Oxford, UK, 1984
- ^ G. Dyker, An Eldorado for Homogeneous Catalysis?, in Organic Synthesis Highlights V, H.-G. Schmaltz, T. Wirth (eds.), pp 48-55, Wiley-VCH, Weinheim, 2003
- ^ Y. Fukuda and K. Utimoto (1991). “Effective transformation of unactivated alkynes into ketones or acetals with a gold(III) catalyst”. J. Org. Chem. 56 (11): 3729. doi:10.1021/jo00011a058.
- ^ A. S. K. Hashmi, T. M. Frost and J. W. Bats (2000). “Highly Selective Gold-Catalyzed Arene Synthesis”. J. Am. Chem. Soc. 122 (46): 11553. doi:10.1021/ja005570d.
- ^ A. Stephen, K. Hashmi, M. Rudolph, J. P. Weyrauch, M. Wölfle, W. Frey and J. W. Bats (2005). “Gold Catalysis: Proof of Arene Oxides as Intermediates in the Phenol Synthesis”. Angewandte Chemie International Edition 44 (18): 2798. doi:10.1002/anie.200462672.
- ^ a b c d 塩化第二金 - 滋賀県公式サイト内にある塩化金(III)の毒性について詳しい記述のあるPDFファイル
- 塩化金(III)のページへのリンク