モノクローナル抗体
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2024/04/07 20:53 UTC 版)
コスト
モノクローナル抗体の製造は、複雑なプロセスが関与したり、その全般的な分子サイズのため、低分子化合物よりもコストが高く、これらはすべて新しい化学物質を患者に提供するための膨大な研究開発費に追加される。それらは、製造業者が多額の投資費用を回収できるように価格設定されており、米国のように価格統制がない場合は、価値が高いほど価格が高くなることがある。ピッツバーグ大学の7人の研究者は、患者一人当たり「mAb療法の年間費用は、腫瘍学および血液学の領域では他の疾病よりも約10万ドル高い」と結論づけた。新血管疾患や代謝性疾患、免疫領域、感染症、アレルギー、眼科の各領域と比較された[48]。
用途
診断検査
ある物質に対するモノクローナル抗体ができれば、それを使ってその物質の存在を検出することができる。タンパク質は、ウェスタンブロットやイムノドットブロットを使用して検出できる。免疫組織化学検査では、モノクローナル抗体を使用して、固定組織切片中の抗原を検出でき、同様に、免疫蛍光検査では、凍結組織切片または生細胞中の物質を検出できる。
分析および化学的用途
抗体はまた、免疫沈降法を使用して、混合物から標的化合物を精製するためにも使用される。
治療用途
治療用モノクローナル抗体は、標的分子の機能の遮断、標的分子を発現している細胞のアポトーシス誘導、またはシグナル伝達経路の調節など、複数の機構を通じて作用する[49][50]。
臨床への応用
モノクローナル抗体の臨床適用
1970年代に発明されたモノクローナル抗体は臨床に革命的な変化を起こすといわれたが、その後ほぼ20年間、臨床試験は上手くいかなかった。これは主に、マウスの抗体はヒトに抗原認識されることが原因であった。しかし1990年代になって、CHO細胞内に、マウスでなくヒトの免疫グロブリン遺伝子を発現するプラスミドを直接形質転換する方法が開発されて以降、この問題は克服された。この方法はさらに進化し、現在ではハイブリドーマを使用せず、ファージディスプレイにより1兆個の分子からなる莫大なクローンライブラリーから最適抗体がスクリーニングされ、その遺伝子をCHO細胞で大量生産する方法が用いられている。もしくは、ヒトの抗体を生産するトランスジェニックマウスを使い、直接ヒト抗体を得る方法が用いられる。これらの方法は、前臨床段階までの開発費がわずか約2億円で済むといわれており、従来の古典的化学薬品にかかる20億円と比較して非常に効率がよい。ただし細胞培養を必要とするため、最終製品の製造費用は化学合成による化学薬品と比べると、非常に高い。
モノクローナル抗体はタンパク質薬品であり、いわゆる化学薬品と違い経口投与ができない(普通週一回の注射)、製造費用が非常に高い、細胞内部に侵入できないなどの欠点を持つ。しかしいったん標的分子に結合すると、患者自身の免疫機構が働いて標的分子を含むがん細胞を高率で破壊できるなどの利点をもつ。また、免疫グロブリン自体はヒトの体内に存在する分子なので、それ自身による副作用は予想しやすい。
原理的にはポリクローナル抗体も臨床に使用可能であるが、人間の患者への薬品として使用するためには、薬品内の分子が化学的に厳密に定義され、さらにそれらを極めて高純度でかつ安定的に大量生産する必要があり、現実にはほぼ不可能であるといわれている。 ヒト血漿由来(血液製剤)の免疫グロブリン製剤は一種のポリクローナル抗体であり、様々な難病に対して使用され有効性を示している。しかし、これら血液由来の免疫グロブリン製剤が組換え抗体医薬品に容易に置き換えることができないのは、上記の品質管理の困難さからである。
事例紹介
癌治療
癌の治療法の一つとして、癌細胞に特異的な抗原にのみ結合し、標的となる癌細胞に対する免疫応答を誘発するモノクローナル抗体が考えられる。このようなモノクローナル抗体は、毒素、放射性同位体、サイトカイン、その他の活性コンジュゲートの送達用に修飾することができる。あるいは、Fab領域で標的抗原およびコンジュゲート(またはエフェクター細胞)の両方に結合できる二重特異性抗体を設計できる。すべてのインタクト抗体は、そのFc領域で細胞受容体または他のタンパク質に結合することができる。
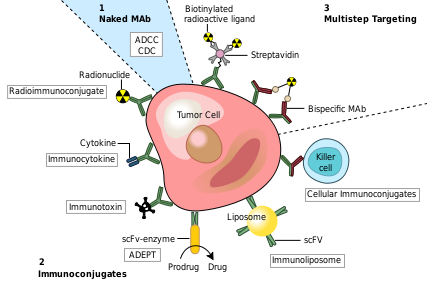
米国食品医薬品局(FDA)が癌に対して承認しているモノクローナル抗体は次のとおりである[52]。
自己免疫疾患
自己免疫疾患に用いられるモノクローナル抗体にはインフリキシマブやアダリムマブがあり、TNF-αに結合して阻害することにより、関節リウマチ、クローン病、潰瘍性大腸炎、強直性脊椎炎に効果がある[53]。バシリキシマブとダクリズマブは、活性化T細胞のIL-2を阻害することにより、腎移植の急性拒絶反応を予防に役立つ[53]。オマリズマブは、ヒト免疫グロブリンE(IgE)を阻害し、中等症から重症のアレルギー性喘息の治療に有用である。
治療用モノクローナル抗体の例
研究用のモノクローナル抗体は、抗体サプライヤーから直接またはCiteAbのような専門家検索エンジンを使用して入手することができる。次は臨床的に重要なモノクローナル抗体の例である。
| 主なカテゴリー | 種類 | 用途 | 機構/標的 | 形態 |
|---|---|---|---|---|
| 抗炎症 | インフリキシマブ[53] | TNF-α阻害 | キメラ | |
| アダリムマブ | TNF-α阻害 | ヒト | ||
| バシリキシマブ[53] |
|
活性化T細胞のIL-2抑制 | キメラ | |
| ダクリズマブ[53] |
|
活性化T細胞のIL-2抑制 | ヒト化 | |
| オマリズマブ |
|
ヒト免疫グロブリンE (IgE) 抑制 | ヒト化 | |
| 抗癌 | ゲムツズマブ[53] |
|
白血病細胞の骨髄細胞表面抗原CD33を標的 | ヒト化 |
| アレムツズマブ[53] |
|
Tリンパ球およびBリンパ球の抗原CD52を標的 | ヒト化 | |
| リツキシマブ[53] |
|
Bリンパ球上のリン酸化タンパク質CD20を標的 | キメラ | |
| トラスツズマブ |
|
HER2/neu (erbB2) 受容体を標的 | ヒト化 | |
| ニモツズマブ |
|
EGFR阻害 | ヒト化 | |
| セツキシマブ |
|
EGFR阻害 | キメラ | |
| ベバシズマブ & ラニビズマブ |
|
VEGF阻害 | ヒト化 | |
| 抗癌および抗ウイルス | バビツキシマブ [54] |
|
免疫療法、ホスファチジルセリンを標的[54] | キメラ |
| 抗ウイルス | 免疫療法、SARS-CoV-2スパイクタンパクを標的 | キメラ | ||
| バムラニビマブ/エテセビマブ[56] | 免疫療法、SARS-CoV-2スパイクタンパクを標的 | キメラ | ||
| その他 | パリビズマブ [53] |
|
RSV融合 (F) タンパク質を阻害 | ヒト化 |
| アブシキシマブ [53] | 血小板上の受容体GpIIb/IIIaを阻害 | キメラ |
病気の迅速診断キット
モノクローナル抗体を使用したイムノクロマト法で各種の迅速診断キットが販売されている。5分から15分で診断できる。 たとえば、感染症にはインフルエンザウイルス、RSウイルス、A群β溶連菌、アデノウイルス、肺炎マイコプラズマ、ヒトメタニュウモウイルス、ノロウイルス、ロタウイルス、肺炎球菌、レジオネラ、病原性大腸菌O157、便中ピロリ菌などである。
副作用
ベバシズマブやセツキシマブなどのいくつかのモノクローナル抗体は、さまざまな種類の副作用を引き起こす可能性がある[57]。これらの副作用は、一般的な副作用と重篤な副作用に分類される[58]。
一般的な副作用には次のものがある。
重大な副作用の可能性として次のものがある。
- ^ “Cytochrome P450 Mediated Drug and Carcinogen Metabolism using Monoclonal Antibodies”. home.ccr.cancer.gov. 2019年6月20日時点のオリジナルよりアーカイブ。2021年5月29日閲覧。
- ^ Gelboin HV, Krausz KW, Gonzalez FJ, Yang TJ (November 1999). “Inhibitory monoclonal antibodies to human cytochrome P450 enzymes: a new avenue for drug discovery”. Trends in Pharmacological Sciences 20 (11): 432–8. doi:10.1016/S0165-6147(99)01382-6. PMID 10542439.
- ^ Tansey EM, Catterall PP (July 1994). “Monoclonal antibodies: a witness seminar in contemporary medical history”. Medical History 38 (3): 322–7. doi:10.1017/s0025727300036632. PMC 1036884. PMID 7934322.
- ^ Schwaber J, Cohen EP (August 1973). “Human x mouse somatic cell hybrid clone secreting immunoglobulins of both parental types”. Nature 244 (5416): 444–7. doi:10.1038/244444a0. PMID 4200460.
- ^ Cambrosio A, Keating P (1992). “Between fact and technique: the beginnings of hybridoma technology”. Journal of the History of Biology 25 (2): 175–230. doi:10.1007/BF00162840. PMID 11623041.
- ^ a b c “The Story of César Milstein and Monoclonal Antibodies”. WhatisBiotechnology.org. 2020年9月23日閲覧。
- ^ Riechmann L, Clark M, Waldmann H, Winter G (March 1988). “Reshaping human antibodies for therapy”. Nature 332 (6162): 323–7. Bibcode: 1988Natur.332..323R. doi:10.1038/332323a0. PMID 3127726.
- ^ Altmann DM (November 2018). “A Nobel Prize-worthy pursuit: cancer immunology and harnessing immunity to tumour neoantigens”. Immunology 155 (3): 283–284. doi:10.1111/imm.13008. PMC 6187215. PMID 30320408.
- ^ Yang J1, Shen MH. Polyethylene glycol-mediated cell fusion. Methods Mol Biol. 2006; 325:59-66.
- ^ National Research Council (US) Committee on Methods of Producing Monoclonal Antibodies. Recommendation 1: Executive Summary: Monoclonal Antibody Production. Washington (DC): National Academies Press (US); 1999. ISBN 978-0-309-07511-4
- ^ a b Ho M, Feng M, Fisher RJ, Rader C, Pastan I (May 2011). “A novel high-affinity human monoclonal antibody to mesothelin”. International Journal of Cancer 128 (9): 2020–30. doi:10.1002/ijc.25557. PMC 2978266. PMID 20635390.
- ^ Seeber S, Ros F, Thorey I, Tiefenthaler G, Kaluza K, Lifke V, Fischer JA, Klostermann S, Endl J, Kopetzki E, Pashine A, Siewe B, Kaluza B, Platzer J, Offner S (2014). “A robust high throughput platform to generate functional recombinant monoclonal antibodies using rabbit B cells from peripheral blood”. PLOS ONE 9 (2): e86184. Bibcode: 2014PLoSO...986184S. doi:10.1371/journal.pone.0086184. PMC 3913575. PMID 24503933.
- ^ Wardemann H, Yurasov S, Schaefer A, Young JW, Meffre E, Nussenzweig MC (September 2003). “Predominant autoantibody production by early human B cell precursors”. Science 301 (5638): 1374–7. Bibcode: 2003Sci...301.1374W. doi:10.1126/science.1086907. PMID 12920303.
- ^ Koelsch K, Zheng NY, Zhang Q, Duty A, Helms C, Mathias MD, Jared M, Smith K, Capra JD, Wilson PC (June 2007). “Mature B cells class switched to IgD are autoreactive in healthy individuals”. The Journal of Clinical Investigation 117 (6): 1558–65. doi:10.1172/JCI27628. PMC 1866247. PMID 17510706.
- ^ Smith K, Garman L, Wrammert J, Zheng NY, Capra JD, Ahmed R, Wilson PC (2009-01-01). “Rapid generation of fully human monoclonal antibodies specific to a vaccinating antigen”. Nature Protocols 4 (3): 372–84. doi:10.1038/nprot.2009.3. PMC 2750034. PMID 19247287.
- ^ Duty JA, Szodoray P, Zheng NY, Koelsch KA, Zhang Q, Swiatkowski M, Mathias M, Garman L, Helms C, Nakken B, Smith K, Farris AD, Wilson PC (January 2009). “Functional anergy in a subpopulation of naive B cells from healthy humans that express autoreactive immunoglobulin receptors”. The Journal of Experimental Medicine 206 (1): 139–51. doi:10.1084/jem.20080611. PMC 2626668. PMID 19103878.
- ^ Huang J, Doria-Rose NA, Longo NS, Laub L, Lin CL, Turk E, Kang BH, Migueles SA, Bailer RT, Mascola JR, Connors M (October 2013). “Isolation of human monoclonal antibodies from peripheral blood B cells”. Nature Protocols 8 (10): 1907–15. doi:10.1038/nprot.2013.117. PMC 4844175. PMID 24030440.
- ^ a b c Ho M (June 2018). “Inaugural Editorial: Searching for Magic Bullets”. Antibody Therapeutics 1 (1): 1–5. doi:10.1093/abt/tby001. PMC 6086361. PMID 30101214.
- ^ Vlasak J, Ionescu R (December 2008). “Heterogeneity of monoclonal antibodies revealed by charge-sensitive methods”. Current Pharmaceutical Biotechnology 9 (6): 468–81. doi:10.2174/138920108786786402. PMID 19075686.
- ^ Beck A, Wurch T, Bailly C, Corvaia N (May 2010). “Strategies and challenges for the next generation of therapeutic antibodies”. Nature Reviews. Immunology 10 (5): 345–52. doi:10.1038/nri2747. PMID 20414207.
- ^ Khawli LA, Goswami S, Hutchinson R, Kwong ZW, Yang J, Wang X, Yao Z, Sreedhara A, Cano T, Tesar D, Nijem I, Allison DE, Wong PY, Kao YH, Quan C, Joshi A, Harris RJ, Motchnik P (2010). “Charge variants in IgG1: Isolation, characterization, in vitro binding properties and pharmacokinetics in rats”. mAbs 2 (6): 613–24. doi:10.4161/mabs.2.6.13333. PMC 3011216. PMID 20818176.
- ^ Zhang T, Bourret J, Cano T (August 2011). “Isolation and characterization of therapeutic antibody charge variants using cation exchange displacement chromatography”. Journal of Chromatography A 1218 (31): 5079–86. doi:10.1016/j.chroma.2011.05.061. PMID 21700290.
- ^ Rathore AS, Winkle H (January 2009). “Quality by design for biopharmaceuticals”. Nature Biotechnology 27 (1): 26–34. doi:10.1038/nbt0109-26. PMID 19131992.
- ^ van der Schoot JM, Fennemann FL, Valente M, Dolen Y, Hagemans IM, Becker AM, Le Gall CM, van Dalen D, Cevirgel A, van Bruggen JA, Engelfriet M, Caval T, Bentlage AE, Fransen MF, Nederend M, Leusen JH, Heck AJ, Vidarsson G, Figdor CG, Verdoes M, Scheeren FA (August 2019). “Functional diversification of hybridoma-produced antibodies by CRISPR/HDR genomic engineering”. Science Advances 5 (8): eaaw1822. doi:10.1126/sciadv.aaw1822. PMC 6713500. PMID 31489367.
- ^ Siegel DL (January 2002). “Recombinant monoclonal antibody technology”. Transfusion Clinique et Biologique 9 (1): 15–22. doi:10.1016/S1246-7820(01)00210-5. PMID 11889896.
- ^ “Dr. George Pieczenik”. LMB Alumni. MRC Laboratory of Molecular Biology (LMB) (2009年9月17日). 2012年12月23日時点のオリジナルよりアーカイブ。2012年11月17日閲覧。
- ^ Schmitz U, Versmold A, Kaufmann P, Frank HG (2000). “Phage display: a molecular tool for the generation of antibodies--a review”. Placenta 21 Suppl A (Suppl A): S106-12. doi:10.1053/plac.1999.0511. PMID 10831134.
- ^ Boulianne GL, Hozumi N, Shulman MJ (1984). “Production of functional chimaeric mouse/human antibody”. Nature 312 (5995): 643–6. doi:10.1038/312643a0. PMID 6095115.
- ^ Chadd HE, Chamow SM (April 2001). “Therapeutic antibody expression technology”. Current Opinion in Biotechnology 12 (2): 188–94. doi:10.1016/S0958-1669(00)00198-1. PMID 11287236.
- ^ Lonberg N, Huszar D (1995). “Human antibodies from transgenic mice”. International Reviews of Immunology 13 (1): 65–93. doi:10.3109/08830189509061738. PMID 7494109.
- ^ “Bristol-Myers Squibb Bets Big on a Mouse”. Bloomberg.com. Bloomberg L.P.. 2021年5月28日閲覧。
- ^ “Amgen Completes Acquisition of Abgenix; Acquisition Provides Amgen with Full Ownership of Panitumumab and Eliminates a Denosumab Royalty | Amgen Inc.”. investors.amgen.com. 2021年5月28日閲覧。
- ^ “Archived copy”. 2009年6月29日時点のオリジナルよりアーカイブ。2009年7月28日閲覧。
- ^ “Proprietary antibody platform”. 2013年2月3日時点のオリジナルよりアーカイブ。2013年1月17日閲覧。
- ^ “Naturally optimized human antibodies”. 2013年11月11日時点のオリジナルよりアーカイブ。2021年5月28日閲覧。
- ^ “Ligand to Acquire OMT, Inc., a Leader in Human Antibody Generation, for $178 Million in Cash and Stock :: Ligand Pharmaceuticals Incorporated (LGND)”. investor.ligand.com. 2021年5月28日閲覧。
- ^ “Proprietary antibody platform”. 2021年5月28日閲覧。
- ^ “Proprietary antibody platform”. 2021年5月28日閲覧。
- ^ McCafferty J, Griffiths AD, Winter G, Chiswell DJ (December 1990). “Phage antibodies: filamentous phage displaying antibody variable domains”. Nature 348 (6301): 552–4. Bibcode: 1990Natur.348..552M. doi:10.1038/348552a0. PMID 2247164.
- ^ Marks JD, Hoogenboom HR, Bonnert TP, McCafferty J, Griffiths AD, Winter G (December 1991). “By-passing immunization. Human antibodies from V-gene libraries displayed on phage”. Journal of Molecular Biology 222 (3): 581–97. doi:10.1016/0022-2836(91)90498-U. PMID 1748994.
- ^ Carmen S, Jermutus L (July 2002). “Concepts in antibody phage display”. Briefings in Functional Genomics & Proteomics 1 (2): 189–203. doi:10.1093/bfgp/1.2.189. PMID 15239904.
- ^ Osbourn JK (2002). “Proximity-guided (ProxiMol) antibody selection”. Antibody Phage Display. Methods Mol. Biol.. 178. pp. 201–5. doi:10.1385/1-59259-240-6:201. ISBN 978-1-59259-240-1. PMID 11968489
- ^ Abeloff MD, Armitage JO, Niederhuber JE, Kastan MB, McKenna G (2008). “Therapeutic Antibodies and Immunologic Conjugates”. Abeloff's Clinical Oncology (4th ed.). Elsevier
- ^ “Cambridge Antibody Technology”. 2011年9月28日時点のオリジナルよりアーカイブ。2021年5月28日閲覧。
- ^ Osbourn JK, Derbyshire EJ, Vaughan TJ, Field AW, Johnson KS (January 1998). “Pathfinder selection: in situ isolation of novel antibodies”. Immunotechnology 3 (4): 293–302. doi:10.1016/S1380-2933(97)10007-0. PMID 9530562.
- ^ “The Current State of Proteomic Technology”. 2011年10月8日時点のオリジナルよりアーカイブ。2009年7月28日閲覧。
- ^ PhRMA Reports Identifies More than 400 Biotech Drugs in Development. Pharmaceutical Technology, August 24, 2006. Retrieved 2006-09-04.
- ^ Hernandez I, Bott SW, Patel AS, Wolf CG, Hospodar AR, Sampathkumar S, Shrank WH (February 2018). “Pricing of monoclonal antibody therapies: higher if used for cancer?”. The American Journal of Managed Care 24 (2): 109–112. PMID 29461857.
- ^ Breedveld FC (February 2000). “Therapeutic monoclonal antibodies”. Lancet 355 (9205): 735–40. doi:10.1016/S0140-6736(00)01034-5. PMID 10703815.
- ^ Australian Prescriber (2006). “Monoclonal antibody therapy for non-malignant disease”. Australian Prescriber 29 (5): 130–133. doi:10.18773/austprescr.2006.079.
- ^ Modified from Carter P (November 2001). “Improving the efficacy of antibody-based cancer therapies”. Nature Reviews. Cancer 1 (2): 118–29. doi:10.1038/35101072. PMID 11905803.
- ^ Takimoto CH, Calvo E. (January 01, 2005) "Principles of Oncologic Pharmacotherapy" in Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ (Eds) Cancer Management
- ^ a b c d e f g h i j Rang HP (2003). Pharmacology. Edinburgh: Churchill Livingstone. pp. 241, for the examples infliximab, basiliximab, abciximab, daclizumab, palivusamab, gemtuzumab, alemtuzumab and rituximab, and mechanism and mode. ISBN 978-0-443-07145-4
- ^ a b Staff, Adis Insight. Bavituximab profile Last updated Jan 27 2016
- ^ "Coronavirus (COVID-19) Update: FDA Authorizes Monoclonal Antibodies for Treatment of COVID-19". U.S. Food and Drug Administration (FDA) (Press release). 21 November 2020. 2020年11月21日閲覧。
 この記述には、アメリカ合衆国内でパブリックドメインとなっている記述を含む。
この記述には、アメリカ合衆国内でパブリックドメインとなっている記述を含む。
- ^ "FDA Authorizes Monoclonal Antibodies for Treatment of COVID-19". U.S. Food and Drug Administration (FDA) (Press release). 10 February 2021. 2021年2月9日閲覧。
 この記述には、アメリカ合衆国内でパブリックドメインとなっている記述を含む。
この記述には、アメリカ合衆国内でパブリックドメインとなっている記述を含む。
- ^ “Monoclonal antibodies to treat cancer | American Cancer Society”. www.cancer.org. 2018年4月19日閲覧。
- ^ “Monoclonal antibody drugs for cancer: How they work”. Mayo Clinic 2018年4月19日閲覧。
- ^ a b “Monoclonal Antibodies: List, Types, Side Effects & FDA Uses (Cancer)”. MedicineNet 2018年4月19日閲覧。
モノクローナル抗体と同じ種類の言葉
- モノクローナル抗体のページへのリンク