水素結合
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2024/02/19 01:21 UTC 版)
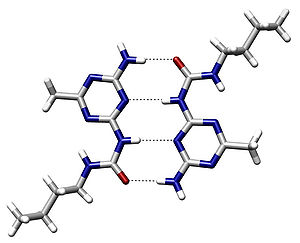
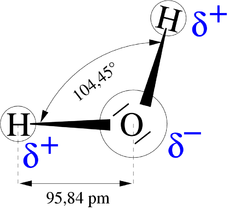
水素結合はもっぱら、陰性原子上で電気的に弱い陽性 (δ+) を帯びた水素が(右上図:水分子の例)周囲の電気的に陰性な原子との間に引き起こす静電的な力として説明されることが多い。つまり、双極子相互作用のうち、特別強いもの、として考えることもできる。ただし水素結合はイオン結合のような無指向性の相互作用ではなく、水素・非共有電子対の相対配置にも依存する相互作用であるため、水素イオン(プロトン)の「キャッチボール」と表現されることもある。
典型的な水素結合(5〜30 kJ/mol)は、ファンデルワールス力より10倍程度強いが、共有結合やイオン結合よりはるかに弱い。水素結合は水などの無機物においても、DNAなどの有機物においても働く。水素結合は水の性質、たとえば相変化などの熱的性質、あるいは水と他の物質との親和性などにおいて重要な役割を担っている。
2011年に、国際純正・応用化学連合(IUPAC)によって作られたタスクグループは、以下のような水素結合の現代的な定義を提案している。
| 「 | 水素結合とは、分子中の水素原子、またはXがHよりも電気陰性度が高い分子断片X–H中の水素原子と、同じまたは異なる分子中の原子または原子のグループとの間の引力的相互作用で、結合が形成されている証拠があるもののことである。 The hydrogen bond is an attractive interaction between a hydrogen atom from a molecule or a molecular fragment X–H in which X is more electronegative than H, and an atom or a group of atoms in the same or a different molecule, in which there is evidence of bond formation. |
」 |
効果と役割
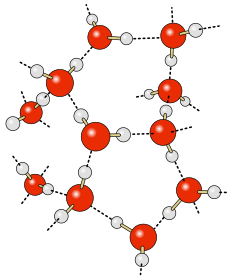
水が同族の他の第16族元素の水素化物(H2S〔沸点: −60.7 ℃〕など)より比較的高い沸点(100 ℃)を示すのは、水素結合によって分子間の引力が非常に強くなるためである。また、水が氷に変化する際に体積が増大するのは、水分子の三角構造が水素結合で蜂の巣状になり、そこに空洞が多く生まれるためである。
生体高分子において水素結合は、タンパク質が二次構造以上の高次構造を形成する際や、核酸の中で核酸塩基同士が相補的に結びつき二重らせん構造が形成する際に必要な、重要な駆動力となっている。
近年では炭素上の水素が陰性原子と作る相互作用(CH-O、CH-N相互作用)や、芳香環と水素との相互作用(CH-π相互作用)も弱い水素結合として認識されるようになってきた[5]。
結合
相対的に電気陰性度が高い原子と共有結合を形成している水素原子は、水素結合供与体(donor、ドナー) である[6]。この場合の陰性原子はフッ素、酸素、窒素などである。フッ素、酸素、窒素などの陰性原子は、水素原子と共有結合しているかいないかにかかわらず、水素結合受容体(acceptor、アクセプター) となる。水素結合供与体の一つの例は、酸素原子と共有結合した水素原子を有するエタノールである。共有結合した水素原子を持たない水素結合受容体の一つの例は、ジエチルエーテルの酸素原子である。
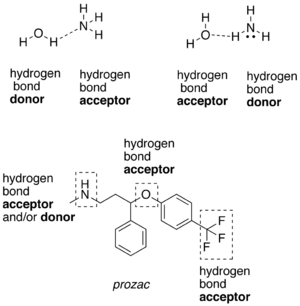
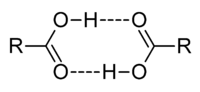
炭素原子に結合した水素原子も、クロロホルム(CHCl3)のように、炭素原子が陰性原子と結合している場合は、水素結合に関与することができる。陰性原子によって、水素原子核の周りの電子雲が分散・引き付けられ、水素原子は部分正電荷を帯びる。水素原子は他の原子や分子と比較して小さいため、生じた電荷や、部分電荷だけでも大きな電荷密度を示す。この強い正電荷密度が、水素結合受容体となるヘテロ原子中の非共有電子対と引き付け、水素結合が形成される。
水素結合はしばしば、静電的な双極子-双極子相互作用として説明される。しかしながら、水素結合は指向性を持ち強力であり、ファン・デル・ワールス半径より短い原子間距離を示し、原子価の一種と解釈される限られた数の相互作用しか大抵形成しないなど、共有結合的な性質も持っている。これらの共有結合様の性質は受容体がより電気陰性なドナー中の水素原子と結合する時により顕著である。
水素結合の部分的な共有結合性は以下のような疑問を提起する: どちらの分子あるいは原子に水素原子核は属しているのだろうか? どちらが供与体でどちらが受容体なのだろうか? 通常は、これらは、単純に X—H...Y 系の原子間距離に基づいて決定される。X—Hの距離は、通常 〜110 pmであるが、H...Yの距離は 〜160から200 pmである。水素結合を示す液体は会合液体(associated liquids) と呼ばれる。
水素結合の強さは、とても弱いもの(1-2 kJ mol−1)から、HF2−[7]のように非常に強いもの (>155 kJ mol−1) まで、様々である。 気相における典型的なエンタルピーは、
- F—H...:F (155 kJ/mol あるいは 40 kcal/mol)
- O—H...:N (29 kJ/mol あるいは 6.9 kcal/mol)
- O—H...:O (21 kJ/mol あるいは 5.0 kcal/mol)
- N—H...:N (13 kJ/mol あるいは 3.1 kcal/mol)
- N—H...:O (8 kJ/mol あるいは 1.9 kcal/mol)
- HO—H...:OH3+ (18 kJ/mol[8] あるいは 4.3 kcal/mol)
である。
水素結合の長さは、結合の強さ、温度、圧力に依存している。結合の強さ自身は、温度、圧力、結合角度、局所的な誘電率などの環境に依存している。典型的な水における水素結合の長さは197 pmである。理想的な結合角度は水素結合供与体の性質に依存している。以下のフッ化水素酸供与体と様々な受容体との水素結合角度は実験的に決定されたものである[9]。
| 受容体···供与体 | 原子価殻電子対反発則 (VSEPR) | 角度 (°) |
| HCN···HF | 直線形 | 180 |
| H2CO ··· HF | 平面三角形 | 110 |
| H2O ··· HF | 四角錐形 | 46 |
| H2S ··· HF | 四角錐形 | 89 |
| SO2 ··· HF | 三角錐形 | 145 |
- ^ Felix H. Beijer, Huub Kooijman, Anthony L. Spek, Rint P. Sijbesma, E. W. Meijer (1998). “Self-Complementarity Achieved through Quadruple Hydrogen Bonding”. Angew. Chem. Int. Ed. 37: 75–78. doi:10.1002/(SICI)1521-3773(19980202)37:1/2<75::AID-ANIE75>3.0.CO;2-R.
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). オンライン版: (2006-) "hydrogen bond".
- ^ E. Arunan, G. R. Desiraju, R. A. Klein, J. Sadlej, S. Scheiner, I. Alkorta, D. C. Clary, R. H. Crabtree, J. J. Dannenberg, P. Hobza, H. G. Kjaergaard, A. C. Legon, B. Mennucci and D. J. Nesbitt. “Definition of the Hydrogen Bond”. 2011年3月13日閲覧。
- ^ IUPAC Physical and Biophysical Chemistry Division (2011年11月10日). “Definition of the hydrogen bond”. Provisional Recommendations. 2011年3月13日閲覧。
- ^ Desiraju, G. R.; Steiner, T. (1999). The Weak Hydrogen Bond: in Structural Chemistry and Biology. ICUr monographs on crystallography 9. Oxford: Oxford Univ. Press. ISBN 978-0198502524
- ^ Campbell, Neil A.; Brad Williamson; Robin J. Heyden (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 0-13-250882-6
- ^ Emsley, J. (1980). “Very Strong Hydrogen Bonds”. Chem. Soc. Rev. 9: 91–124. doi:10.1039/cs9800900091.
- ^ Omer Markovitch and Noam Agmon (2007). “Structure and energetics of the hydronium hydration shells”. J. Phys. Chem. A 111 (12): 2253–2256. doi:10.1021/jp068960g. PMID 17388314.
- ^ A. C. Legon;D. J. Millen. (1987). Chem. Soc. Rev. 16: 467-498. doi:10.1039/CS9871600467.
- ^ Tom Sidney Moore and Thomas Field Winmill (1912). “CLXXVII.—The state of amines in aqueous solution”. J. Chem. Soc., Trans. 101: 1635. doi:10.1039/CT9120101635.
- ^ a b Wendell M. Latimer, Worth H. Rodebush (1920). “Polarity and ionization from the standpoint of the lewis theory of valence”. J. Am. Chem. Soc. 42 (7): 1419–1433. doi:10.1021/ja01452a015.
- ^ a b W. L. Jorgensen and J. D. Madura (1985). “Temperature and size dependence for Monte Carlo simulations of TIP4P water”. Mol. Phys. 56 (6): 1381. doi:10.1080/00268978500103111.
- ^ Jan Zielkiewicz (2005). “Structural properties of water: Comparison of the SPC, SPCE, TIP4P, and TIP5P models of water”. J. Chem. Phys. 123 (10): 104501. doi:10.1063/1.2018637. PMID 16178604.
- ^ Michel Baron, Sylviane Giorgi-Renault, Jean Renault, Patrick Mailliet, Daniel Carré et Jean Etienne (1984). “Hétérocycles à fonction quinone. V. Réaction anormale de la butanedione avec la diamino-1,2 anthraquinone; structure cristalline de la naphto [2,3-f] quinoxalinedione-7,12 obtenue”. Can. J. Chem. 62 (3): 526–530. doi:10.1139/v84-087.
- ^ Damien Laage and James T. Hynes (2006). “A Molecular Jump Mechanism for Water Reorientation”. Science 311 (5762): 832. doi:10.1126/science.1122154. PMID 16439623.
- ^ Omer Markovitch & Noam Agmon (2008). “The Distribution of Acceptor and Donor Hydrogen-Bonds in Bulk Liquid Water”. Molecular Physics 106: 485. doi:10.1080/00268970701877921.
- ^ a b R. H. Crabtree, Per E. M. Siegbahn, Odile Eisenstein, Arnold L. Rheingold, Thomas F. Koetzle (1996). “A New Intermolecular Interaction: UnconventionalHydrogen Bonds with Element−Hydride Bonds as ProtonAcceptor”. Acc. Chem. Res. 29 (7): 348–354. doi:10.1021/ar950150s.
- ^ E. D. Isaacs, A. Shukla, P. M. Platzman, D. R. Hamann, B. Barbiellini, and C. A. Tulk (1999). “Covalency of the Hydrogen Bond in Ice: A Direct X-Ray Measurement”. Phys. Rev. Lett. 82: 600-603. doi:10.1103/PhysRevLett.82.600.
- ^ Dingley, A. J.; Grzesiek, S. (1998). “Direct Observation of Hydrogen Bonds in Nucleic Acid Base Pairs by Internucleotide 2JNN Couplings”. J. Am. Chem. Soc. 120 (33): 8293–8297. doi:10.1021/ja981513x.
- ^ F. Cordier, M. Rogowski, S. Grzesiek and A. Bax (1999). “Observation of through-hydrogen-bond 2hJHC‘ in a perdeuterated protein”. J. Magn. Reson. 140 (2): 510–2. doi:10.1006/jmre.1999.1899. PMID 10497060.
- ^ Cordier, F.; Grzesiek, S. (1999). “Direct Observation of Hydrogen Bonds in Proteins by Interresidue 3hJNC‘ Scalar Couplings”. J. Am. Chem. Soc. 121 (7): 1601–1602. doi:10.1021/ja983945d.
- ^ “Law-breaking liquid defies the rules”. physicsworld.com (2004年9月24日). 2011年3月13日閲覧。
水素結合と同じ種類の言葉
- 水素結合のページへのリンク