硝酸マグネシウム
硝酸マグネシウム
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/11/05 05:35 UTC 版)

|
|

|
|
| 物質名 | |
|---|---|
|
Magnesium nitrate |
|
|
別名
Nitromagnesite (六水和物) |
|
| 識別情報 | |
|
|
|
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.030.739 |
| EC番号 |
|
|
PubChem CID
|
|
| RTECS number |
|
| UNII |
|
| 国連/北米番号 | 1474 |
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| 性質 | |
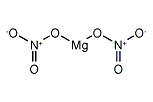
| Mg(NO3)2 | |
| モル質量 | 148.32 g/mol (無水物) 184.35 g/mol (二水和物) 256.41 g/mol (六水和物) |
| 外観 | 白色の結晶性固体 |
| 密度 | 2.3 g/cm3 (無水物) 2.0256 g/cm3 (二水和物) 1.464 g/cm3 (六水和物) |
| 融点 | 129 °C (264 °F; 402 K) (二水和物) 88.9 °C (六水和物) |
| 沸点 | 330 °C (626 °F; 603 K) 分解 |
| 71 g/100 mL (25 °C)[1] | |
| 溶解度 | エタノール、アンモニアに溶ける |
| 屈折率 (nD) | 1.34 (六水和物) |
| 構造 | |
| 立方晶系 | |
| 熱化学 | |
| 標準定圧モル比熱, Cp⦵ | 141.9 J/mol K |
| 標準モルエントロピー S⦵ | 164 J/mol K |
|
標準生成熱 (ΔfH⦵298)
|
−790.7 kJ/mol |
|
ギブズの 自由エネルギー (ΔfG⦵) |
−589.4 kJ/mol |
| 危険性 | |
| 労働安全衛生 (OHS/OSH): | |
|
主な危険性
|
刺激性 |
| GHS表示: | |
  |
|
| Warning | |
| H272, H315, H319, H335 | |
| P210, P220, P221, P261, P264, P271, P280, P302+P352, P304+P340, P305+P351+P338, P312, P321, P332+P313, P337+P313, P362, P370+P378, P403+P233, P405, P501 | |
| NFPA 704(ファイア・ダイアモンド) | |
| 安全データシート (SDS) | External MSDS |
| 関連する物質 | |
| その他の 陽イオン |
硝酸バリウム;硝酸ストロンチウム;硝酸カルシウム |
|
特記無き場合、データは標準状態 (25 °C [77 °F], 100 kPa) におけるものである。
|
|
硝酸マグネシウム(しょうさんマグネシウム、Magnesium nitrate)は組成式 Mg(NO3)2 で表される、マグネシウムの硝酸塩である。無水物は市販されず、6水和物として市販されている。
合成
水酸化マグネシウム水溶液と硝酸による中和反応、または炭酸マグネシウムを硝酸に溶解して水溶液が得られる[2][3]。
水溶液を濃縮すると6水和物 が析出する。また飽和水溶液に濃硝酸を加えると2水和物Mg(NO3)2·2H2Oが析出する。
性質
無色結晶で水に溶解しやすく潮解性をもち、6水和物は単斜晶系に属する。 水、エタノール及びアセトンに可溶である。
6水和物は融点以上で分解が始まり塩基性塩を生成し、さらに400℃程度に加熱すると酸素および二酸化窒素を放出して酸化マグネシウムとなる。
-
3 Mg(NO
3)
2 · 6H
2O → Mg
3(OH)
2(NO
3)
4 · 4H
2O + 2HNO
3 + 14H
2O -
2 Mg(NO
3)
2 → 2MgO + 4NO
2 + O
2
参考文献
- 硝酸マグネシウムのページへのリンク




![{\displaystyle {{\text{Mg(OH)2}}{}+{}2\,\mathrm {HNO} {\vphantom {A}}_{\smash[{t}]{3}}{}\mathrel {\longrightarrow } {}{\text{Mg(NO3)2}}{}+{}2\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0005796b339e48da1e7f66c71be0f56f81acaa96)
![{\displaystyle {{\text{MgCO3}}{}+{}2\,\mathrm {HNO} {\vphantom {A}}_{\smash[{t}]{3}}{}\mathrel {\longrightarrow } {}{\text{Mg(NO3)2}}{}+{}{\text{CO2}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/20ec546e9d0b61f1bf7115a1823503b5d11d17f9)
![{\displaystyle {\mathrm {Mg} (\mathrm {NO} {\vphantom {A}}_{\smash[{t}]{3}}){\vphantom {A}}_{\smash[{t}]{2}}~\cdot 6\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/16d6f68f365e6e1fe97ec73a1ee82d2849238366)
