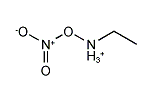
硝酸エチルアンモニウム
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/04/09 13:00 UTC 版)
| 硝酸エチルアンモニウム | |
|---|---|
 |
|
 |
|
|
硝酸エチルアンモニウム |
|
| 識別情報 | |
| CAS登録番号 | 22113-86-6  |
| PubChem | 6432248 |
| ChemSpider | 4937507  |
| EC番号 | 690-858-8 |
| ChEBI | |
|
|
|
|
| 特性 | |
| 化学式 | [CH 3CH 2NH 3]+ [NO 3]− |
| モル質量 | 108.0965 g/mol |
| 外観 | 無色の液体 |
| 密度 | 1.261 g/cm3 |
| 融点 | 12 °C, 285 K, 54 °F |
| 沸点 | 240 °C, 513 K, 464 °F |
| 熱化学 | |
| 標準定圧モル比熱, Cp |
206 J/(mol·K) |
| 危険性 | |
| 安全データシート(外部リンク) | [1] |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
硝酸エチルアンモニウム(英: Ethylammonium nitrate)または、硝酸エチルアミン(英: Ethylamine nitrate、EAN)は[1]、化学式[CH
3CH
2NH
3]+
[NO
3]−
を持つ塩である。硝酸エチルアンモニウムは無臭で、無色またはわずかに黄色がかった液体であり、融点は12 °Cである[2]。この化合物は、1914年にパウル・ヴァルデンによって分類され[3][4]、最初に報告された室温イオン液体の例であると考えられている[5]。
合成と特性
硝酸エチルアンモニウムは、硝酸エチルをアンモニアのアルコール溶液と共に加熱するか[6]、またはエチルアミンを濃硝酸と反応させることによって合成することができる[4]。それは25 °C において0.28 ポアズ(0.028 Pa·s)という比較的低い粘度を持ち、そのため同じく25 °C において約20 mS·cm−1という高い電気伝導率を持つ。また、240 °Cで沸騰し、約250 °Cで分解する[7]。さらに、密度は20 °Cにおいて1.261 g/cm3である[8] 。
エチルアンモニウムイオン(CH
3CH
2NH+
3)は、中心の窒素原子の周りに四面体状に配置された、容易に脱離可能な3つのプロトンを持つ一方、NO−
3アニオンの配置は平面状である。構造的な違いにもかかわらず、硝酸エチルアンモニウムは水と多くの特性を共有しており、例えばミセル形成、炭化水素の凝集、気体の溶解における負のエンタルピーおよびエントロピーなどがある。水と同様に、硝酸エチルアンモニウムは三次元の水素結合ネットワークを形成することができる[9]。
用途
硝酸エチルアンモニウムは、電気化学における導電性溶媒として、およびタンパク質結晶化剤として使用される[10][11]。それは変性したリゾチームの再生(リフォールディング)に対して正の効果を持ち、その再生収率は約90%である。その再生作用は次のように説明される。硝酸エチルアンモニウムのエチル基はタンパク質の疎水性部分と相互作用し、それによって分子間会合から保護する一方、硝酸エチルアンモニウムの荷電部分は静電相互作用を安定化させる[12]。
脚注
- ^ Wagaman, Kerry L Liquid monopropellant United States Patent 6001197, Publication Date 12/14/1999
- ^ Marsh, K.N.; Boxall, J.A.; Lichtenthaler, R. (2004). “Room temperature ionic liquids and their mixtures—a review”. Fluid Phase Equilibria 219: 93–98. doi:10.1016/j.fluid.2004.02.003.
- ^ P. Walden (1914). Chem. Zentralbl. 85: 1800–1801.
- ^ a b P. Walden (1914). “Ueber die Molekulargrösse und elektrische Leitfähigkeit einiger geschmolzenen Salze”. Bull. Acad. Imper. Sci. St. Pétersbourg. 6 8: 405–422.
- ^ Mihkel Koel (2008). Ionic Liquids in Chemical Analysis. CRC Press. p. xxvii. ISBN 978-1-4200-4646-5
- ^ Rudolph Fittig (2008). Wohler's Outlines of Organic Chemistry. Read Books. p. 56. ISBN 978-1-4097-9043-3
- ^ Ionic liquids & ionic liquid acids with high temperature stability for fuel cell and other high temperature applications, method of making and cell employing same United States Patent Application 20070026295, Google patents link[リンク切れ]
- ^ “Safety Data Sheet”. Carlroth. 2016年9月19日閲覧。
- ^ Allen, Martin; Evans, D. Fennell; Lumry, Rufus (1985). “Thermodynamic properties of the ethylammonium nitrate + water system: Partial molar volumes, heat capacities, and expansivities”. Journal of Solution Chemistry 14 (8): 549. doi:10.1007/BF00649520.
- ^ Garlitz, Jennifer A.; Summers, Catherine A.; Flowers, Robert A.; Borgstahl, Gloria E. O. (1999). “Ethylammonium nitrate: a protein crystallization reagent”. Acta Crystallographica D 55 (12): 2037–8. doi:10.1107/S0907444999011774. PMID 10666583.
- ^ M. Riad Manaa (2005). Chemistry at extreme conditions. Elsevier. p. 441. ISBN 0-444-51766-9
- ^ Jochen Decker, Udo Reischl (2004). Molecular diagnosis of infectious diseases. Humana Press. p. 247. ISBN 1-58829-221-5
- 硝酸エチルアンモニウムのページへのリンク