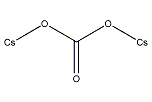
炭酸ジセシウム
炭酸セシウム
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2020/06/01 10:47 UTC 版)
ナビゲーションに移動 検索に移動| 炭酸セシウム | |
|---|---|
 |
|
|
炭酸セシウム |
|
| 識別情報 | |
| CAS登録番号 | 534-17-8 |
| 特性 | |
| 化学式 | Cs2CO3 |
| モル質量 | 325.8198 g/mol |
| 外観 | 無色結晶または白色粉末 |
| 密度 | 4.072 g/cm3 |
| 融点 | 610℃(分解) |
| 水への溶解度 | 260.5 g/100 cm3水 (15 ℃) |
| 熱化学 | |
| 標準生成熱 ΔfH |
−1139.7 kJ mol−1[1] |
| 標準モルエントロピー S |
204.47 J mol−1K−1 |
| 標準定圧モル比熱, Cp |
123.85 J mol−1K−1 |
| 危険性 | |
| EU分類 | 刺激性 (Xi) |
| EU Index | Not listed |
| Rフレーズ | R36/37/38 |
| Sフレーズ | S22, S26 |
| 引火点 | 不燃性 |
| 関連する物質 | |
| 関連物質 | 炭酸リチウム 炭酸ナトリウム 炭酸カリウム 炭酸ルビジウム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
炭酸セシウム(たんさんセシウム、caesium carbonate/cesium carbonate)は組成式Cs2CO3で表されるセシウムの炭酸塩である。
製法
炭酸セシウムは以下のような方法で合成でき同様の方法は炭酸ルビジウムにも応用できる[2]。
- セシウム塩水溶液に硫酸アルミニウム水溶液を加えると、溶解度の小さいセシウム明礬が析出する。
- 得られた水溶液に二酸化炭素を通じて過剰の水酸化バリウムを炭酸バリウムとして除き、さらに二酸化炭素を通じて得られた水溶液を蒸発乾固して固体を得る。
- また塩化セシウムから以下の手順で合成される。
- この硝酸セシウムを白金皿中で4倍量のシュウ酸と加熱反応させシュウ酸セシウムとする。
- シュウ酸セシウムを空気中で焼き、分解すると炭酸セシウムが残る。
性質
無色結晶であり、水に易溶で潮解性をもつ。無水物のほか、3水和物が存在する。水溶液はアルカリ性を示す。エタノールおよびジエチルエーテルにも可溶である。
用途
酸化エチレンの重合触媒、各種セシウム塩および特殊ガラスの原料として用いられる。
脚注
- ^ D.D. Wagman, W.H. Evans, V.B. Parker, R.H. Schumm, I. Halow, S.M. Bailey, K.L. Churney, R.I. Nuttal, K.L. Churney and R.I. Nuttal, The NBS tables of chemical thermodynamics properties, J. Phys. Chem. Ref. Data 11 Suppl. 2 (1982).
- ^ 日本化学会編 『新実験化学講座 無機化合物の合成II』 丸善、1977年
|
||||||
- 炭酸セシウムのページへのリンク