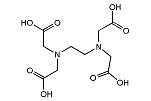
EDTA
| 分子式: | C10H16N2O8 |
| その他の名称: | エデチン酸、ハビドート、セクエストレンAA、エチレンジアミン四酢酸、エチレンジニトリロ四酢酸、EDTA、Havidote、Edetic acid、Sequestrene AA、Ethylenediaminetetraacetic acid、Ethylenedinitrilotetraacetic acid、N,N'-(1,2-Ethanediyl)bis[N-(carboxymethyl)glycine]、エデト酸、Versene、ベルセン、エチレンジアミン-N,N,N',N'-四酢酸、Ethylenediamine-N,N,N',N'-tetraacetic acid、2,2',2'',2'''-(Ethylenebisnitrilo)tetraacetic acid、(Ethylenedinitrilo)tetraacetic acid、Ethylendiaminetetraacetic acid、エチレンジアミンテトラ酢酸、[Ethylenebis(nitrilo)]tetraacetic acid、N,N'-(Ethane-1,2-diyl)bis[N-(carboxymethyl)glycine]、N,N'-Ethylenebis[N-(carboxymethyl)glycine]、2,2',2'',2'''-(Ethylenedinitrilo)tetrakisacetic acid、Ethylenebisnitrilotetraacetic acid、N,N,N',N'-Tetrakis(2-oxo-2-hydroxyethyl)ethane-1,2-diamine |
| 体系名: | N,N,N',N'-テトラキス(カルボキシメチル)エチレンジアミン、(エチレンビスニトリロ)四酢酸、N,N'-[1,2-エタンジイル]ビス[N-(カルボキシメチル)グリシン]、[1,2-エタンジイルビス(ニトリロ)]四酢酸、エチレンビスニトリロ四酢酸、(エチレンジニトリロ)テトラ酢酸、2,2',2'',2'''-(エチレンビスニトリロ)四酢酸、N,N'-(1,2-エタンジイル)ビス[N-(カルボキシメチル)グリシン]、(エチレンジニトリロ)四酢酸、[エチレンビス(ニトリロ)]四酢酸、N,N'-(エタン-1,2-ジイル)ビス[N-(カルボキシメチル)グリシン]、N,N'-エチレンビス[N-(カルボキシメチル)グリシン]、2,2',2'',2'''-(エチレンジニトリロ)テトラキス酢酸、エチレンビスニトリロテトラ酢酸、N,N,N',N'-テトラキス(2-オキソ-2-ヒドロキシエチル)エタン-1,2-ジアミン |
エチレンジアミン四酢酸
(エデト酸 から転送)
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/11/11 05:13 UTC 版)

|
|

|
|
| 物質名 | |
|---|---|
|
2,2',2'',2'''-(Ethane-1,2-diyldinitrilo)tetraacetic acid
|
|
|
2-({2-[bis(carboxymethyl)amino]ethyl}(carboxymethyl)amino)acetic acid
|
|
|
別名
エチレンジアミン四酢酸 |
|
| 識別情報 | |
|
3D model (JSmol)
|
|
| 略称 | EDTA, H4EDTA |
| バイルシュタイン | 1716295 |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.000.409 |
| EC番号 |
|
| Gmelin参照 | 144943 |
| KEGG | |
| MeSH | Edetic+Acid |
|
PubChem CID
|
|
| RTECS number |
|
|
日化辞番号
|
|
| UNII |
|
| 国連/北米番号 | 3077 |
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| 性質 | |
| C10H16N2O8 | |
| モル質量 | 372.24 |
| 示性式 | (HOOCCH2)2NCH2CH2N(CH2COOH)2 |
| 外観 | 白色粉末 |
| 密度 | 0.86 g/cm3 |
| 融点 | 237–245 °C 510-518 K (分解) |
| 酸解離定数 pKa | pK1=0.0 (CO2H) (µ=1.0) pK2=1.5 (CO2H) (µ=0.1) pK3=2.00 (CO2H) (µ=0.1) pK4=2.69 (CO2H) (µ=0.1) pK5=6.13 (NH+) (µ=0.1) pK6=10.37 (NH+) (µ=0.1)[1] |
| 熱化学 | |
|
標準生成熱 (ΔfH⦵298)
|
−1765.4 to −1758.0 kJ mol−1 |
| 標準燃焼熱 ΔcH |
−4461.7 to −4454.5 kJ mol−1 |
| 薬理学 | |
| S01XA05 (WHO) V03AB03 (WHO) (塩) | |
| 投与経路 |
|
| 危険性 | |
| GHS表示: | |
 |
|
| Warning | |
| H319 | |
| P305+P351+P338 | |
| NFPA 704(ファイア・ダイアモンド) | |
| 致死量または濃度 (LD, LC) | |
|
半数致死量 LD50
|
1000 mg/kg (経口, ラット)[2] |
|
特記無き場合、データは標準状態 (25 °C [77 °F], 100 kPa) におけるものである。
|
|

|
|
| 識別情報 | |
|---|---|
|
3D model (JSmol)
|
|
| ECHA InfoCard | 100.000.409 |
| KEGG | |
|
CompTox Dashboard (EPA)
|
|
|
|
| 性質 | |
| モル質量 | 372.24 |
| 外観 | 無色結晶 |
| 融点 | 248 °C (478 °F; 521 K) 分解 |
|
特記無き場合、データは標準状態 (25 °C [77 °F], 100 kPa) におけるものである。
|
|
エチレンジアミン四酢酸(エチレンジアミンしさくさん、ethylenediaminetetraacetic acid)は、金属キレーション剤の1種であり、EDTA あるいはエデト酸と呼ばれることがある。EDTA自体は水に溶けにくいため、後述の様々な利用法で用いるのはEDTAの塩である。通常、とくに断りのない場合、 EDTA はジナトリウム塩であり、日本薬局方ではエデト酸ナトリウムである。ジナトリウム塩であることを正確に記述したい場合や強調したい場合などは、エチレンジアミン四酢酸二ナトリウム、エチレンジアミン四酢酸二水素二ナトリウム、EDTA・2Na、などと記述される。
錯体の形成

EDTAはキレート剤であり、Ag+、Ca2+、Cu2+、Fe3+、Zr4+ などのそれぞれ1価、2価、3価、4価の金属イオンとキレート錯体を形成する(キレート結合)。特にカルシウム、銅、鉄(3価)、コバルト(3価)とは強く結合する。この特性を利用してキレート滴定に広く使われている。EDTAは4つのカルボン酸と2つの3級アミンを持つため、酸塩基反応にも利用される。
使用例
EDTAが持つ金属イオンをキレート(錯化)する性質を利用して、硬水中のMg2+やCa2+をキレートさせて捕集することで軟水化することができ、その目的でシャンプーなどの化粧品に添加される。あるいは金属中毒の治療剤として処方される場合もある。
特に重要な利用法として以下のようなものがある。
- 工業的洗浄 - 重金属表面に付着したカルシウム、マグネシウムの錯化除去。
- 合成洗剤の添加物 - カルシウム、マグネシウムの除去(水の軟水化)
- 写真工業 - 鉄(III)-EDTA錯体の酸化剤としての利用。
- パルプ・製紙業 - 非塩素系漂白剤を使用する際に生じる過酸化水素の安定化を目的とした重金属の錯化除去。
- 繊維工業 - 漂白剤安定化のための重金属錯化除去。
- 農業 - 主に石灰質土壌において、EDTAに鉄、亜鉛、銅を錯化させた状態でまいて、その土壌に乏しい植物の必須元素を補う、肥料としての利用。
またその他にも以下のような利用法が挙げられる。
- 食料品 - 酸化防止剤、金属封鎖剤(遊離してきた金属イオンを錯体として捕獲して油脂などの酸化を触媒しないようにする)として利用される。これらの用途から「保存料」と書かれることもある[3][4]。
- 乳製品・飲料 - 乳成分由来の汚れの除去。
- 石油生産 - 無機物の沈殿を防ぐためのボアホールでの利用。
- 排気ガス - 窒素酸化物の除去。
- 化粧品 - 酸化防止剤(油脂の酸化を触媒する金属イオンを捕らえる)としての利用。
- 医薬品 - 急性高カルシウム血症、鉛中毒の治療[注釈 1]。一部の採血管において抗凝固剤として利用[注釈 2]。
- 歯科治療 - 歯の根管の洗浄(無機物の除去)。
- その他の治療 - デトックス、キレーション治療、キレート療法等と称し、主にアメリカで行われているという。これに関連してEDTAを合成アミノ酸と呼ぶ例が見られる。確かに広義のアミノ酸に違いないが、大衆向け広告の表現としては疑問がある。
科学の分野では以下のように利用される。
環境への影響
微生物による分解を受けにくいため、水処理としてはやや難易度の高い処理が必要である。一般に次亜塩素酸ナトリウム添加による酸化分解法が採られるが、重金属等の共存下では事前実験が必要である。
ヨーロッパでは使用が規制されている。また、世界保健機関では、飲料水水質ガイドラインとして、0.6 (mg/L)と定めている。これは、EDTAが亜鉛をキレートして、飲料水から亜鉛が摂取できなくなり、亜鉛欠乏に陥ることもあることを懸念しての策である。
注釈
- ^ 金属イオンを錯体にして、腎臓からの排泄を促す。
- ^ 血液凝固にはカルシウムイオンが必要なのだが、これをEDTAがキレートすることで凝固を防止する。ただし、採血検査の目的によっては他の抗凝固剤が用いられることもある。なお、生体内では抗凝固剤としては利用しない。あくまで、採血した血液の凝固を防止するために用いられる。
- ^ 例えば、水の硬度の決定などを行う。ただし、通常はキレート滴定の終点を知るための指示薬が別に必要となる。
出典
- ^ Harris, D.C. "Quantitative Chemical Analysis", 7th ed., W. H. Freeman and Compagny, New York, 2007
- ^ Substance Name: Sodium calcium edetate. NIH.gov
- ^ 食品添加物基礎講座(その18) - 品質の維持に関わる食品添加物(3)
- ^ エチレンジアミン四酢酸カルシウム二ナトリウム
関連項目
エデト酸と同じ種類の言葉
- エデト酸のページへのリンク