三臭化リン
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2017/05/08 03:16 UTC 版)
| 三臭化リン | |
|---|---|
 |
|
 |
|
|
三臭化リン |
|
|
別称
臭化リン(III)
|
|
| 識別情報 | |
| CAS登録番号 | 7789-60-8  |
| EINECS | 232-178-2 |
| RTECS番号 | TH4460000 |
| 特性 | |
| 化学式 | PBr3 |
| モル質量 | 270.70 g/mol |
| 外観 | 無色透明の液体 |
| 密度 | 2.852 g/cm3, 液体 |
| 融点 |
-41.5 ℃ (231.7 K) |
| 沸点 |
173.2 ℃ (446.4 K) |
| 水への溶解度 | 加水分解 |
| 構造 | |
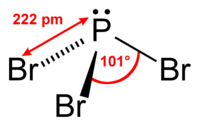
| 分子の形 | 三角錐形 |
| 危険性 | |
| EU分類 | 腐食性 (C) |
| EU Index | 015-103-00-6 |
| Rフレーズ | R14, R34, R37 |
| Sフレーズ | (S1/2), S26, S45 |
| 関連する物質 | |
| その他の陰イオン | 三フッ化リン 三塩化リン 三ヨウ化リン |
| その他の陽イオン | 三臭化窒素 三臭化ヒ素 三臭化アンチモン |
| 関連物質 | 五臭化リン 臭化ホスホリル |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
化学的性質
三塩化リンや三フッ化リンと同じように、ルイス酸とルイス塩基の両方の性質を併せ持つ。例としては、ルイス塩基として三臭化ホウ素と1:1の安定な錯体(Br3B-PBr3)を形成するというものがある。それと同時に求電子試薬として、あるいはルイス酸としてアミンを始めとする様々な化合物と反応する。
最も重要な反応の一つは、アルコールのヒドロキシ基 (−OH) を臭素が置換し、臭化アルキルを生成させるというものである。三臭化リンの3つの臭素原子は全て置換可能である。
アルコールの酸素原子が求電子的なリン原子により活性化されると同時に臭素原子がアニオンとして脱離し、このアニオンがアルコールのα炭素に攻撃するという、SN2型反応により反応が進行する。
この反応はSN2反応であるため、アルコールは1級もしくは2級である必要がある。アルコールのα炭素がキラルである場合、立体構造が反転することに注意が必要である。
似たような反応では、カルボン酸からカルボン酸臭化物を生成させる。
強力な還元剤としても用いられ、三塩化リンより酸化されやすい。酸素と爆発的に反応し、五酸化二リンと臭素を発生させる。
合成
既にある三臭化リンに溶解させた白リンと、臭素を反応させることで新たに三臭化リンが得られる。五臭化リンを生成させないため、リンを過剰に用いる。
|
||||||
- 三臭化リンのページへのリンク


