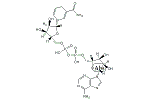
NADH
| 分子式: | C21H29N7O14P2 |
| 慣用名: | 還元型コエンザイムI、還元型ニコチンアミドアデニンジヌクレオチド、還元型コデヒドロゲナーゼI、還元型ジホスホピリジンヌクレオチド、還元型コデヒドラーゼI、還元型CoI、β-NADH、NADH、β-DPNH、DPNH、Reduced codehydrase I、1,4-Dihydronicotinamide adenine dinucleotide、Dihydrocodehydrogenase I、Reduced nicotinamide-adenine dinucleotide、Reduced Co I、Reduced coenzyme I、Reduced codehydrogenase I、還元型補発酵素、1,4-ジヒドロニコチンアミドアデニンジヌクレオチド、ジヒドロコデヒドロゲナーゼI、NADH2、還元型補酵素I、還元ジホスホピリジンヌクレオチド、Dihydrocozymase、Reduced diphosphopyridine nucleotide、ジヒドロニコチンアミドアデニンジヌクレオチド、還元コデヒドロゲナーゼI、還元ニコチンアミドアデニン二りん酸、ジヒドロニコチンアミドモノヌクレオチド、還元ニコチンアミドアデニンジヌクレオチド、ジヒドロコジマーゼ、NADH2、Dihydronicotinamide adenine dinucleotide、Reduced nicotinamide adenine diphosphate、Dihydronicotinamide mononucleotide、Adenosine 5'-[diphosphoric acid P2-[1-(1,4-dihydro-3-carbamoylpyridin-1-yl)-1,5-dideoxy-β-D-ribo-pentofuranos-5-yl]] ester、1-[5-O-(5'-Adenylyloxyphosphonyl)-β-D-ribofuranosyl]-1,4-dihydronicotinamide、Adenosine 5'-[diphosphoric acid β-[1-(3-carbamoyl-1,4-dihydropyridine-1-yl)-1,5-dideoxy-β-D-ribofuranose-5-yl]] ester |
| 体系名: | アデノシン5'-[二りん酸P2-[1-(1,4-ジヒドロ-3-カルバモイルピリジン-1-イル)-1,5-ジデオキシ-β-D-ribo-ペントフラノース-5-イル]]、1-[5-O-(5'-アデニリルオキシホスホニル)-β-D-リボフラノシル]-1,4-ジヒドロニコチンアミド、アデノシン5'-[二りん酸β-[1-(3-カルバモイル-1,4-ジヒドロピリジン-1-イル)-1,5-ジデオキシ-β-D-リボフラノース-5-イル]] |
ニコチンアミドアデニンジヌクレオチド
(NADH から転送)
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/10/12 20:06 UTC 版)

|
|

|
|
| 物質名 | |
|---|---|
|
別名
Diphosphopyridine nucleotide (DPN+), Coenzyme I |
|
| 識別情報 | |
|
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.000.169 |
|
IUPHAR/BPS
|
|
| KEGG | |
|
PubChem CID
|
|
| RTECS number |
|
| UNII |
|
|
|
|
|
| 性質 | |
| C21H28N7O14P2+ (酸化型) C21H29N7O14P2 (還元型) |
|
| モル質量 | 664.4 g/mol (酸化型) 665.4 g/mol (還元型) |
| 外観 | 白色の粉末 |
| 融点 | 160 °C (320 °F; 433 K) |
| 危険性 | |
| NFPA 704(ファイア・ダイアモンド) | |
|
特記無き場合、データは標準状態 (25 °C [77 °F], 100 kPa) におけるものである。
|
|
ニコチンアミドアデニンジヌクレオチド (英: nicotinamide adenine dinucleotide) とは、全ての真核生物と多くの古細菌、真正細菌で用いられる電子伝達体である。さまざまな脱水素酵素の補酵素として機能し、酸化型 (NAD+) および還元型 (NADH) の2つの状態を取り得る。二電子還元を受けるが、中間型は生じない。略号であるNAD+(あるいはNADでも同じ)のほうが論文や口頭でも良く使用されている。またNADH2とする人もいるが間違いではない。
かつては、ジホスホピリジンヌクレオチド (DPN)、補酵素I、コエンザイムI、コデヒドロゲナーゼIなどと呼ばれていたが、NAD+に統一されている。別名、ニコチン酸アミドアデニンジヌクレオチドなど。
構造と物理化学的特性
NAD+はニコチンアミドモノヌクレオチドおよびアデノシンからなる物質であり、ヌクレオチドの5'がそれぞれリン酸結合によって結合している構造を取る。アデノシンの2'には-OH基が付属しており、これがリン酸基に置換されると、NADP+となる。
酸化還元反応に関与しているのは、ニコチンアミドであり、酸化型および還元型の構造は図の通りである。(還元型は4位の炭素に立体特異性がみられる。)

上図では、水素原子が1つだけ付加されたように見えるが、ニコチンアミドのN+が電子によって還元されるために、結果として2つの水素原子を運搬しているのと同じ状態となる。すなわち、全体としての二電子酸化還元反応は以下の通りである。
-

UV吸収スペクトル アデニン塩基を含むことから、NAD+とNADHはともに強いUV吸収を示す。NAD+の吸収ピークは259 nmで、モル吸光係数は16,900 M−1cm−1である。一方、還元型のNADHのみ、339 nmに第2の吸収ピークを持ち、そのモル吸光係数は6,220 M−1cm−1である。この第2のピークは酸化型のNAD+には存在しないため、分光光度計を用い波長340nmあるいは339nmの吸光度を測定することでNAD+とNADHの間の酸化還元反応を簡単に測定することができる。[1]脱水素酵素活性測定にはこの方法が良く用いられている。
NAD+とNADHは蛍光にも差が存在している。水溶液中のNADHは460 nmをピークとする寿命0.4 nsの蛍光を発するが、NAD+は蛍光を発しない。[2]NADHの蛍光特性はタンパク質に結合すると変化するため、これを用いて解離定数を測定することができる。[2][3]また蛍光顕微鏡を使って生細胞の酸化還元状態を測定することも可能である。[4]
生理学的意義
NAD+は生物のおもな酸化還元反応の多くにおいて必須成分(補酵素)であり、好気呼吸(酸化的リン酸化)の中心的な役割を担う。解糖系およびクエン酸回路より糖あるいは脂肪酸の酸化によって還元物質NADHが得られる。還元物質NADHを生産する好気呼吸反応系は以下の通りである。なお、酸化物質および還元物質を太字で表記する。
NADH生成経路
- エムデン-マイヤーホフ経路
→「解糖系 § エムデン-マイヤーホフ経路」も参照- グリセルアルデヒド3リン酸 + NAD+ → 1,3-ジホスホグリセリン酸 + NADH (グリセルアルデヒド3リン酸脱水素酵素、EC 1.2.1.12)
- ピルビン酸 + SH-CoA + NAD+ → アセチルCoA + NADH + CO2 (ピルビン酸脱水素酵素複合体、EC 1.8.1.4))
- イソクエン酸 + NAD+ → α-ケトグルタル酸 + NADH + CO2(イソクエン酸脱水素酵素、EC 1.1.1.41)
- α-ケトグルタル酸 + NAD+ + SH-CoA → スクシニルCoA + NADH + CO2(α-ケトグルタル酸脱水素酵素、EC 1.2.4.2.)
- リンゴ酸 + NAD+ → オキサロ酢酸 + NADH(リンゴ酸脱水素酵素、EC 1.1.1.37)
- パルミトイルCoA + 7CoA + 7FAD + 7NAD+ + 7H2O

- NADHのページへのリンク