カドヘリン【cadherin】
カドヘリン
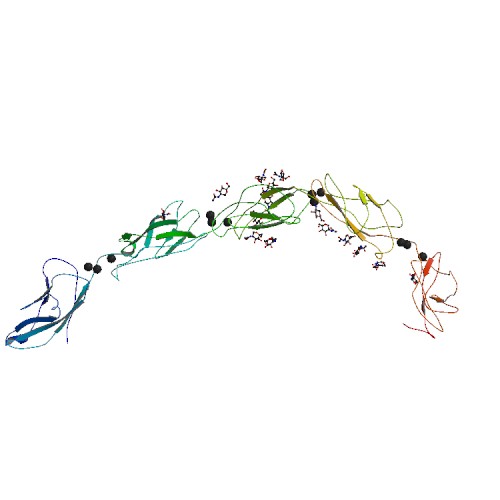
カドヘリンは細胞と細胞を結合させる細長いタンパク質で、ドメインが数珠繋ぎになった構造をしている。ドメインとドメインはカルシウムイオンで構造が安定化されている。カドヘリンの末端は細胞膜を突き抜けて、細胞内のタンパク質であるβカテニンと結合し、βカテニンはαカテニンを介して細胞の骨格を形成するアクチンと結合する。つまり、細胞と細胞は、隣の細胞→カドヘリン(細胞外)→カドヘリン(細胞内)→βカテニン→αカテニン→アクチンというタンパク質の相互作用によって安定化されているのである。

CC Attribution-Noncommercial-Share Alike 3.0 Unported
カドヘリン
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2024/07/19 05:26 UTC 版)

カドヘリン (Cadherin) は細胞表面に存在する糖タンパク質の一群で、細胞接着をつかさどる分子であり、動物の胚発生に重要な役割を果たす[1]。典型的なカドヘリン(クラシックカドヘリン)は、アドヘレンス・ジャンクションの構築を通じて、細胞と細胞の接着の形成と維持に関わる。クラシックカドヘリンは、その細胞外に5つのドメイン構造(ECドメイン)を繰り返し、1つの膜貫通セグメントと細胞内ドメインを有する。細胞内ドメインにはカテニンが結合し、細胞骨格への連結を行っている。カドヘリンは、その機能発現にカルシウムイオンを必要とし、カルシウムイオン存在下でプロテアーゼによる分解から保護される。カルシウム calcium と接着 adhere にちなみ、その発見者であるAron Mosconaや竹市雅俊らにより命名された。ECドメインをもつ分子は脊椎動物ゲノム中に120個ほど見いだされ、カドヘリンスーパーファミリーと呼ばれている。
カドヘリンの例
- クラシックカドヘリン(Eカドヘリン、Nカドヘリン、Pカドヘリン): 最初に発見されたEカドヘリンは、歴史的にはL-CAM(ニワトリ)、ウボモルリンなどとも呼ばれていた。
- プロトカドヘリン
- Flamingo
- Fat
- デスモソーマルカドヘリン
カドヘリンの機能
細胞接着、胚発生、形態形成、がんの浸潤・転移、シナプス形成、シナプス可塑性。
脚注
- ^ “デジタル大辞泉の解説”. コトバンク. 2018年2月12日閲覧。
外部リンク
カドヘリン
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2021/09/14 14:54 UTC 版)
「日本の発明・発見の一覧」の記事における「カドヘリン」の解説
1986年には竹市雅俊がカドヘリンを発見し、カドヘリンが細胞間接着を担う分子であることを突き止めた。
※この「カドヘリン」の解説は、「日本の発明・発見の一覧」の解説の一部です。
「カドヘリン」を含む「日本の発明・発見の一覧」の記事については、「日本の発明・発見の一覧」の概要を参照ください。
固有名詞の分類
- カドヘリンのページへのリンク