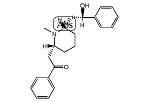
ロベリン
| 分子式: | C22H27NO2 |
| その他の名称: | ロベリン、l-ロベリン、(-)-ロベリン、Lobeline、l-Lobeline、(-)-Lobeline、(-)-α-[(2R,6S)-6-[(S)-β-hydroxyphenethyl]-1-methyl-2-piperidinyl]acetophenone、Inflatine、Lobelin、ロブニコ、インフラチン、Lobnico、(-)-α-[(2R,6S)-6-[(βS)-β-Hydroxyphenethyl]-1-methyl-2-piperidinyl]acetophenone、1-Phenyl-2-[(2R,6S)-1-methyl-6-[(2S)-2-hydroxy-2-phenylethyl]-2-piperidinyl]ethanone |
| 体系名: | α-[(2R)-6β-[(2S)-2-ヒドロキシ-2-フェニルエチル]-1-メチル-2β-ピペリジニル]アセトフェノン、2-[(2R)-6β-[(2S)-2-ヒドロキシ-2-フェニルエチル]-1-メチル-2β-ピペリジニル]-1-フェニルエタノン、α-[(2R)-6β-[(S)-β-ヒドロキシフェネチル]-1-メチルピペリジン-2β-イル]アセトフェノン、(-)-α-[(2R,6S)-6-[(βS)-β-ヒドロキシフェネチル]-1-メチル-2-ピペリジニル]アセトフェノン、(-)-α-[(2R,6S)-6-[(S)-β-ヒドロキシフェネチル]-1-メチル-2-ピペリジニル]アセトフェノン、1-フェニル-2-[(2R,6S)-1-メチル-6-[(2S)-2-ヒドロキシ-2-フェニルエチル]-2-ピペリジニル]エタノン |
ロベリン
ロベリン
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2023/05/06 09:07 UTC 版)
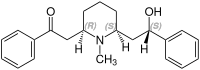 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| Drugs.com | 国別販売名(英語) International Drug Names |
| 識別 | |
| CAS番号 | 90-69-7  |
| ATCvetコード | QV04CV01 (WHO) |
| PubChem | CID: 101616 |
| ChemSpider | 91814  |
| UNII | D0P25S3P81  |
| KEGG | D02364  |
| ChEMBL | CHEMBL2103769  |
| 化学的データ | |
| 化学式 | C22H27NO2 |
| 分子量 | 337.455 |
| |
ロベリン(Lobeline)とはニコチン様構造を有するアルカロイドの一つであり、呼吸興奮薬として用いられる。末梢の化学受容器に作用して呼吸興奮作用を示す。ロベリア属の植物(ロベリアソウ(Lobelia inflata )、デビルズ・タバコ(Lobelia tupa )、カーディナル・フラワー(Lobelia cardinalis )、オオロベリアソウ(Lobelia siphilitica ))やホシアザミ(Hippobroma longiflora )から発見された。ミゾカクシ(Lobelia chinensis )にも含まれている。白い粉末状の物質で、水によく溶ける。
依存症治療
ロベリンは錠剤の形で禁煙補助剤として使われる[1][2][3]。また、覚醒剤[4][5]、コカイン[6]等の薬物依存症やアルコール依存症[7]の治療薬として使われる場合もある。
作用機序
ロベリンの作用部位は複数ある。単剤で用いるとVMAT2に結合[8][9][10]してドーパミンを弱く放出させるが、メタンフェタミンが作用している場合にはそのドーパミン分泌作用を減少させる[11][12]。ドーパミンとセロトニンの再取り込みを阻害し[13]、その結果細胞外ドメインのサブユニットに繋がるニコチン受容体[14]に対して刺激・拮抗両効果を示す[15][16]。μ-オピオイド受容体拮抗作用も持つ[17]。
関連項目
出典
- ^ Stead LF, Hughes JR; Hughes (2012). “Lobeline for smoking cessation”. Cochrane Database Syst Rev 2: CD000124. doi:10.1002/14651858.CD000124.pub2. PMID 22336780.
- ^ Marlow, S. P.; Stoller, J. K. (2003). “Smoking cessation”. Respiratory care 48 (12): 1238–54; discussion 1254–6. PMID 14651764.
- ^ Buchhalter, A. R.; Fant, R. V.; Henningfield, J. E. (2008). “Novel pharmacological approaches for treating tobacco dependence and withdrawal: Current status”. Drugs 68 (8): 1067–88. doi:10.2165/00003495-200868080-00005. PMID 18484799.
- ^ Neugebauer, N. M.; Harrod, S. B.; Stairs, D. J.; Crooks, P. A.; Dwoskin, L. P.; Bardo, M. T. (2007). “Lobelane decreases methamphetamine self-administration in rats”. European Journal of Pharmacology 571 (1): 33–8. doi:10.1016/j.ejphar.2007.06.003. PMC 2104779. PMID 17612524.
- ^ Eyerman, D. J.; Yamamoto, B. K. (2005). “Lobeline attenuates methamphetamine-induced changes in vesicular monoamine transporter 2 immunoreactivity and monoamine depletions in the striatum”. Journal of Pharmacology and Experimental Therapeutics 312 (1): 160–9. doi:10.1124/jpet.104.072264. PMID 15331654.
- ^ Polston, J. E.; Cunningham, C. S.; Rodvelt, K. R.; Miller, D. K. (2006). “Lobeline augments and inhibits cocaine-induced hyperactivity in rats”. Life Sciences 79 (10): 981–90. doi:10.1016/j.lfs.2006.05.006. PMID 16765386.
- ^ Farook, J. M.; Lewis, B; Gaddis, J. G.; Littleton, J. M.; Barron, S (2009). “Lobeline, a nicotinic partial agonist attenuates alcohol consumption and preference in male C57BL/6J mice”. Physiology & Behavior 97 (3–4): 503–6. doi:10.1016/j.physbeh.2009.02.031. PMID 19268674.
- ^ Zheng, G; Dwoskin, L. P.; Crooks, P. A. (2006). “Vesicular monoamine transporter 2: Role as a novel target for drug development”. The AAPS Journal 8 (4): E682–92. doi:10.1208/aapsj080478. PMC 2751365. PMID 17233532.
- ^ Zheng, F; Zheng, G; Deaciuc, A. G.; Zhan, C. G.; Dwoskin, L. P.; Crooks, P. A. (2007). “Computational neural network analysis of the affinity of lobeline and tetrabenazine analogs for the vesicular monoamine transporter-2”. Bioorganic & Medicinal Chemistry 15 (8): 2975–92. doi:10.1016/j.bmc.2007.02.013. PMC 2001191. PMID 17331733.
- ^ Zheng, G; Dwoskin, L. P.; Deaciuc, A. G.; Norrholm, S. D.; Crooks, P. A. (2005). “Defunctionalized lobeline analogues: Structure-activity of novel ligands for the vesicular monoamine transporter”. Journal of Medicinal Chemistry 48 (17): 5551–60. doi:10.1021/jm0501228. PMC 3617589. PMID 16107155.
- ^ Wilhelm, C. J.; Johnson, R. A.; Eshleman, A. J.; Janowsky, A (2008). “Lobeline effects on tonic and methamphetamine-induced dopamine release”. Biochemical Pharmacology 75 (6): 1411–5. doi:10.1016/j.bcp.2007.11.019. PMC 2435375. PMID 18191815.
- ^ Wilhelm, C. J.; Johnson, R. A.; Lysko, P. G.; Eshleman, A. J.; Janowsky, A (2004). “Effects of methamphetamine and lobeline on vesicular monoamine and dopamine transporter-mediated dopamine release in a cotransfected model system”. Journal of Pharmacology and Experimental Therapeutics 310 (3): 1142–51. doi:10.1124/jpet.104.067314. PMID 15102929.
- ^ Zheng, G; Horton, D. B.; Deaciuc, A. G.; Dwoskin, L. P.; Crooks, P. A. (2006). “Des-keto lobeline analogs with increased potency and selectivity at dopamine and serotonin transporters”. Bioorganic & Medicinal Chemistry Letters 16 (19): 5018–21. doi:10.1016/j.bmcl.2006.07.070. PMC 3934794. PMID 16905316.
- ^ PDB entry en:Template:PDBe. Hansen, S. B.; Sulzenbacher, G; Huxford, T; Marchot, P; Taylor, P; Bourne, Y (2005). “Structures of Aplysia AChBP complexes with nicotinic agonists and antagonists reveal distinctive binding interfaces and conformations”. The EMBO Journal 24 (20): 3635–46. doi:10.1038/sj.emboj.7600828. PMC 1276711. PMID 16193063.
- ^ Damaj, M. I.; Patrick, G. S.; Creasy, K. R.; Martin, B. R. (1997). “Pharmacology of lobeline, a nicotinic receptor ligand”. The Journal of Pharmacology and Experimental Therapeutics 282 (1): 410–9. PMID 9223582.
- ^ Miller, D. K.; Harrod, S. B.; Green, T. A.; Wong, M. Y.; Bardo, M. T.; Dwoskin, L. P. (2003). “Lobeline attenuates locomotor stimulation induced by repeated nicotine administration in rats”. Pharmacology, Biochemistry, and Behavior 74 (2): 279–86. doi:10.1016/s0091-3057(02)00996-6. PMID 12479946.
- ^ Miller, D. K.; Lever, J. R.; Rodvelt, K. R.; Baskett, J. A.; Will, M. J.; Kracke, G. R. (2007). “Lobeline, a potential pharmacotherapy for drug addiction, binds to mu opioid receptors and diminishes the effects of opioid receptor agonists”. Drug and Alcohol Dependence 89 (2–3): 282–91. doi:10.1016/j.drugalcdep.2007.02.003. PMID 17368966.
ロベリンと同じ種類の言葉
固有名詞の分類
- ロベリンのページへのリンク