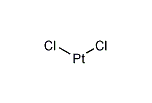二塩化白金
塩化白金(II)
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2024/07/02 18:45 UTC 版)
| 塩化白金(II) | |
|---|---|

| |

|

|
| 識別情報 | |
| CAS登録番号 | 10025-65-7 |
| ChemSpider | 2668 |
| 特性 | |
| 化学式 | PtCl2 |
| モル質量 | 265.99 g/mol |
| 密度 | 6.05 g/cm3, 固体 |
| 融点 |
581 ℃ |
| 沸点 |
分解 |
| 構造 | |
| 結晶構造 | 六方晶系 |
| 熱化学 | |
| 標準生成熱 ΔfH |
−123.4 kJ mol−1[1] |
| 危険性 | |
| EU分類 | 有害 (Xn) |
| EU Index | Not listed |
| Rフレーズ | R42/43 |
| Sフレーズ | S22, S24, S37, S45 |
| 引火点 | 不燃性 |
| 関連する物質 | |
| 関連物質 | テトラクロリド白金(II)酸 塩化白金(IV) ヘキサクロリド白金(IV)酸 ヘキサクロリド白金(IV)酸カリウム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
塩化白金(II)(えんかはっきん に、platinum(II) chloride)は、化学式が PtCl2 で表される2価の白金の塩化物である。他の白金化合物の合成の出発物質として非常に重要な物質である。
合成
β-PtCl2 は、空気中でヘキサクロリド白金(IV)酸を 350 ℃ まで加熱することによって得られる。ヘキサクロリド白金(IV)酸水溶液はヒドラジンで還元できるが、他の方法より手間がかかる[2]。

β-PtCl2の構造。立方格子の頂点・中心を削除し、立方体と、それに内接した八面体が交わる点に白金原子、それ以外の点に塩素原子をおく。 用途
塩化白金(II)の反応は、ほとんどが配位子 (L) との錯体生成反応であり、これらによって Pt-Cl-Pt 結合の間を通して解重合が行われる。
- 塩化白金(II)のページへのリンク