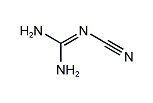
ジシアンジアミド
| 分子式: | C2H4N4 |
| その他の名称: | シアノグアニジン、ジシアンジアミド、Dicyandiamide、N-Cyanoguanidine、Dicyanodiamide、ジシアノジアミン、Param、パラム、3-Cyanoguanidine、1-Cyanoguanidine、Cyanoguanidine、N''-Cyanoguanidine、Amidinocyanamide、(Diaminomethylene)cyanamide、(Amidinoamino) cyanide、(Cyanoimino)methanediamine、ジシアノジアミド、2-Cyanoguanidine、Dicyanodiamine |
| 体系名: | 2-シアノグアニジン、3-シアノグアニジン、N-シアノグアニジン、1-シアノグアニジン、N''-シアノグアニジン、アミジノシアナミド、(ジアミノメチレン)シアナミド、(アミジノアミノ)シアニド、(シアノイミノ)メタンジアミン |
ジシアンジアミド
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/10/10 22:50 UTC 版)
|
|||
| 物質名 | |||
|---|---|---|---|
|
2-Cyanoguanidine |
|||
|
別名
Cyanoguanidine, dicyanodiamide, N-cyanoguanidine, 1-cyanoguanidine, guanidine-1-carbonitrile, dicyandiamin, Didin, DCD, Dicy |
|||
| 識別情報 | |||
|
3D model (JSmol)
|
|
||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.006.649 | ||
| EC番号 |
|
||
|
PubChem CID
|
|||
| RTECS number |
|
||
| UNII | |||
|
CompTox Dashboard (EPA)
|
|||
|
|||
|
|||
| 性質 | |||
| C2H4N4 | |||
| モル質量 | 84.08 g/mol | ||
| 外観 | 白色の結晶 | ||
| 密度 | 1.400 g/cm3 | ||
| 融点 | 209.5 °C (409.1 °F; 482.6 K) | ||
| 沸点 | 252 °C (486 °F; 525 K) | ||
| 41.3 g/l | |||
| log POW | −0.52 | ||
| kH | 2.25×10−10 atm·m3/mol | ||
| 磁化率 | −44.55×10−6 cm3/mol | ||
| 危険性 | |||
| GHS表示: | |||
 |
|||
| Warning | |||
| H302, H312, H332 | |||
| P261, P264, P270, P271, P280, P301+P312, P302+P352, P304+P312, P304+P340, P312, P322, P330, P363, P501 | |||
|
特記無き場合、データは標準状態 (25 °C [77 °F], 100 kPa) におけるものである。
|
|||
ジシアンジアミド(英語: dicyandiamide)は、グアニジンから誘導されるニトリルである。シアナミドの二量体であり、これから合成することができる。無色の固体で、水、アセトンおよびアルコールに溶けるが、非極性有機溶媒には溶けない[1]。2-シアノグアニジン、DICY(ダイサイ)などとも呼ばれる。
合成と性質
石灰窒素を水と酸で反応させてシアナミド溶液にし、これを加熱重合させる。あるいは、反応を石灰窒素泥中で同時に行い熱水で抽出し結晶を得る。
グアニジンやメラミンなど様々な有機化合物はジシアンジアミドから合成されている。例えば、アセトグアナミンやベンゾグアナミンはシアノグアニジンとニトリルの縮合によって合成される[2][3]。
- (H2N)2C=NCN + RCN → (CNH2)2(CR)N3
シアノグアニジンは緩効性肥料としても使われる。かつて火薬の原料として使われていた。
エポキシ樹脂の硬化剤として使用されることがあるが、単独では硬化温度が180℃以上と高く、硬化時の発熱も大きいためイミダゾールアダクト等三級アミンを触媒として併用される。この場合シェルフライフが室温で3ヶ月以上となり一液性エポキシ(接着剤)として充分な保存条件を満たす。一般的にエポキシ樹脂100に対して約12が化学等量であるが反応後の三級アミンが触媒となり3~12の配合比率であっても実用上充分な機能を持つ。
化学
ニトリル基が結合する窒素原子のプロトン化により互変異性体を生じる。
酸塩基反応により双性イオンの形態で存在することもできる。
双性イオン型からアンモニア(NH3)が失われ、続いて残りの中心の窒素原子が脱プロトン化されると、ジシアナミドアニオン [N(CN)2]− が得られる。
出典
- ^ Thomas Güthner; Bernd Mertschenk (2006). “Cyanamides”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a08_139.pub2. ISBN 3527306730.
- ^ H. Deim; G. Matthias; R. A. Wagner (2012). “Amino Resins”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a02_115.pub2. ISBN 978-3527306732.
- ^ J. K. Simons; M. R. Saxton (1953). “Benzoguanamine”. Organic Syntheses 33: 13. doi:10.15227/orgsyn.033.0013.
ジシアンジアミドと同じ種類の言葉
固有名詞の分類
- ジシアンジアミドのページへのリンク