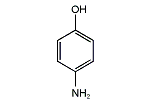
4‐アミノフェノール
| 分子式: | C6H7NO |
| その他の名称: | アゾール、ウナール、シトール、ロジナール、パラノール、アクチボール、ウルソールP、セルチナール、ベンゾフルP、Azol、Unal、Citol、Activol、Paranol、Rodinal、Ursol P、Certinal、C.I.76550、Benzofur P、4-Aminophenol、C.I.Oxidation Base 6、C.I.オキシデーションベース6、ウルソールPベース、ペラゴールPベース、ペラゴールグレーPベース、Ursol P Base、Pelagol P Base、Pelagol Grey P Base、p-Aminophenol、p-Hydroxyaniline、パラ-アミノフェノール、4-Hydroxyaniline |
| 体系名: | 4-ヒドロキシアニリン、p-アミノフェノール、4-アミノフェノール、p-ヒドロキシアニリン |
4-アミノフェノール
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/08/28 03:55 UTC 版)
| 4-アミノフェノール | |
|---|---|
 |
 |
|
別称
|
|
| 識別情報 | |
|
3D model (JSmol)
|
|
| バイルシュタイン | 385836 |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.004.198 |
| EC番号 |
|
| Gmelin参照 | 2926 |
| KEGG | |
| MeSH | Aminophenols |
|
PubChem CID
|
|
| UNII | |
| 国連/北米番号 | 2512 |
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| 特性 | |
| 化学式 | C6H7NO |
| モル質量 | 109.13 g mol−1 |
| 外観 | 無色または赤黄色の結晶 |
| 密度 | 1.13 g/cm3 |
| 融点 | 187.5 °C, 461 K, 370 °F |
| 沸点 | 284 °C, 557 K, 543 °F |
| 水への溶解度 | 1.5 g/100 mL |
| 溶解度 |
|
| log POW | 0.04 |
| 酸解離定数 pKa |
|
| 構造 | |
| 直方晶系 | |
| 熱化学 | |
| 標準生成熱 ΔfH |
−190.6 kJ/mol |
| 危険性 | |
| GHS表示: | |
   |
|
| Warning | |
| H302, H332, H341, H410 | |
| P201, P202, P261, P264, P270, P271, P273, P281, P301+P312, P304+P312, P304+P340, P308+P313, P312, P330, P391, P405, P501 | |
| NFPA 704(ファイア・ダイアモンド) | |
| 引火点 | 195 °C (383 °F; 468 K) (cc) |
| 致死量または濃度 (LD, LC) | |
|
半数致死量 LD50
|
671 mg/kg |
| 関連する物質 | |
| 関連するアミノフェノール | 2-アミノフェノール 3-アミノフェノール |
| 関連物質 | アニリン フェノール |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
4-アミノフェノール (4-aminophnol, または para-aminophenol, または p-aminophenol) は、化学式 H2NC6H4OH で表される有機化合物である。通常、白色粉末として入手できる[3]。"Rodinal" の商品名で市販されているモノクロフィルムの現像剤として普通に使われている。4-アミノフェノールは、わずかに親水性の性質を反映して、アルコールに適度に溶け、熱水から再結晶することができる。塩基の存在で、速やかに酸化される。メチル化された誘導体の N-メチルアミノフェノールとN,N-ジメチルアミノフェノールは、商業的に価値がある。4-アミノフェノールは、3つのアミノフェノール異性体の一つである。他の 2つは2-アミノフェノールと3-アミノフェノールである。
製造
フェノールから
4-アミノフェノールは、フェノールのニトロ化とそれに続く鉄による還元で生成される。または、ニトロベンゼンの部分的水素化によりフェニルヒドロキシルアミンが得られ、主として 4-アミノフェノールに転移する[4]。
- C6H5NO2 + 2 H2 → C6H5NHOH + H2O
- C6H5NHOH → HOC6H4NH2
ニトロベンゼンから
ニトロベンゼンから電解変換 (electric conversion) してフェニルヒドロキシルアミンを生成し、これが自発的に転位して4-アミノフェノールになる[5]。
使用例
4-アミノフェノールは、有機化学においてビルディングブロックとして用いられる。特に、Paracetamol (パラセタモール) の工業的合成の最終中間体である。4-アミノフェノールと無水酢酸を反応させるとパラセタモールが得られる[6][7][8]。
脚注
- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. (2014). p. 690. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4
- ^ Haynes, William M., ed (2016). CRC Handbook of Chemistry and Physics (97th ed.). CRC Press. pp. 5–89. ISBN 978-1498754286
- ^ CRC Handbook of Chemistry and Physics 65th Ed.
- ^ Mitchell, S.C. & Waring, R.H. "Aminophenols." In Ullmann’s Encyclopedia of Industrial Chemistry; 2002 Wiley-VCH, doi:10.1002/14356007.a02_099
- ^ Polat, K.; Aksu, M.L.; Pekel, A.T. (2002), “Electroreduction of nitrobenzene to p-aminophenol using voltammetric and semipilot scale preparative electrolysis techniques”, Journal of Applied Electrochemistry (Kluwer Academic Publishers) 32: 217–223, doi:10.1023/A:1014725116051
- ^ Ellis, Frank (2002). Paracetamol: a curriculum resource. Cambridge: Royal Society of Chemistry. ISBN 0-85404-375-6
- ^ Anthony S. Travis (2007). “Manufacture and uses of the anilines: A vast array of processes and products”. In Zvi Rappoport. The chemistry of Anilines Part 1. Wiley. p. 764. ISBN 978-0-470-87171-3
- ^ Elmar Friderichs; Thomas Christoph; Helmut Buschmann. “Analgesics and Antipyretics”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheima: Wiley-VCH. doi:10.1002/14356007.a02_269.pub2. ISBN 978-3-527-30673-2.
- 4-アミノフェノールのページへのリンク