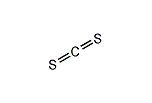ジチイラン-3,3-ジイルラジカル
セシウム(Ce2)
二硫化炭素
二硫化炭素
(cs 2 から転送)
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/11/11 04:21 UTC 版)

|
|

|
|
| 物質名 | |
|---|---|
|
二硫化炭素 |
|
| 識別情報 | |
|
3D model (JSmol)
|
|
| バイルシュタイン | 1098293 |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.000.767 |
| EC番号 |
|
| KEGG | |
|
PubChem CID
|
|
| RTECS number |
|
| UNII | |
| 国連/北米番号 | 1131 |
|
CompTox Dashboard (EPA)
|
|
|
|
|
|
| 性質 | |
| CS2 | |
| モル質量 | 76.139 g/mol |
| 外観 | 無色液体(低純度のものは黄色がかっている) |
| 密度 | 1.261 g/cm3 |
| 融点 | −110.8 °C (−167.4 °F; 162.3 K) |
| 沸点 | 46.3 °C (115.3 °F; 319.4 K) |
| 0.258 g/100 mL (0 °C) 0.239 g/100 mL (10 °C) 0.217 g/100 mL (20 °C)[1] 0.014 g/100 mL (50 °C) |
|
| 溶解度 | アルコール、ジエチルエーテル、ベンゼン、油 |
| 蒸気圧 | 48.1 kPa (25 °C) 82.4 kPa (40 °C)[2] |
| 磁化率 | −42.2·10−6 cm3/mol |
| 屈折率 (nD) | 1.6295 |
| 構造 | |
| 直線型 | |
| 0 D (20 °C)[3] | |
| 熱化学 | |
| 標準定圧モル比熱, Cp⦵ | 75.73 J/(mol·K)[3] |
| 標準モルエントロピー S⦵ | 151 J/(mol·K)[3] |
|
標準生成熱 (ΔfH⦵298)
|
88.7 kJ/mol[3] |
|
ギブズの 自由エネルギー (ΔfG⦵) |
64.4 kJ/mol[3] |
| 標準燃焼熱 ΔcH |
1687.2 kJ/mol[2] |
| 危険性 | |
| 労働安全衛生 (OHS/OSH): | |
|
吸入による危険性
|
刺激性; 神経毒素 |
|
目への危険性
|
刺激性 |
|
皮膚への危険性
|
刺激性 |
| GHS表示:[6] | |
   |
|
| Danger | |
| H225, H315, H319, H332, H361fd, H372 | |
| P202, P210, P281, P303+P361+P353, P304+P340+P312, P305+P351+P338, P308+P313 ICSC 0022 |
|
| NFPA 704(ファイア・ダイアモンド) | |
| 引火点 | −43 °C (−45 °F; 230 K)[3] |
| 102 °C (216 °F; 375 K)[3] | |
| 爆発限界 | 1.3–50%[4] |
| 致死量または濃度 (LD, LC) | |
|
半数致死量 LD50
|
3188 mg/kg (ラット, 経口) |
|
半数致死濃度 LC50
|
>1670 ppm (ラット, 1 時間) 15500 ppm (ラット, 1 時間) 3000 ppm (ラット, 4 時間) 3500 ppm (ラット, 4 時間) 7911 ppm (ラット, 2 時間) 3165 ppm (マウス, 2 時間)[5] |
|
LCLo (最低致死濃度)
|
4000 ppm (ヒト, 30 分)[5] |
| NIOSH(米国の健康曝露限度): | |
|
PEL
|
TWA 20 ppm C 30 ppm 100 ppm (30-minute maximum peak)[4] |
|
REL
|
TWA 1 ppm (3 mg/m3) ST 10 ppm (30 mg/m3) [skin][4] |
|
IDLH
|
500 ppm[4] |
| 関連する物質 | |
| 関連物質 | 二酸化炭素 硫化カルボニル 二セレン化炭素 |
|
特記無き場合、データは標準状態 (25 °C [77 °F], 100 kPa) におけるものである。
|
|
二硫化炭素(にりゅうかたんそ、英: carbon disulfide)は代表的な炭素の硫化物で、化学式は CS2。無色で揮発性の液体であり、主にセロハンやレーヨンの製造過程で溶剤として利用されているほか、ゴムの加硫促進剤、有機化学原料や浮遊選鉱剤などに用いられている。二硫炭、硫化炭素、硫炭などと略される。劇物。
化学的性質
純度が高いものはエーテル様の芳香を持つ無色の液体だが、保存中に分解しやすく一般的には硫化カルボニルのような悪臭を持つ夾雑物が含まれ黄色を呈する。
酸素 (O)と硫黄 (S)が同族であることから、二酸化炭素 (CO2)と等電子的な分子であるが、二硫化炭素は非常に燃えやすい。また求核剤と反応しやすく、容易に還元されやすい。この反応性の違いは、硫黄の場合原子核のπ電子供与能が酸素より低く、そのため炭素原子が求電子性を示すためと考えられる。
製造
自然界では火山や沼地から微量に放出されるのみである[7]。
工業的には木炭・コークスなどの固体の炭素源を用いて硫黄蒸気と反応させる固相-気相反応および、天然ガス(メタン)を炭素源として硫黄蒸気と反応させる気相反応の二種類の方法によって製造される。いずれの方法においても硫化水素が副生し、クラウス法で硫黄として再回収される[8]。
固相-気相反応での反応温度は約900°C。この方法は反応装置に鋳鉄で作られたレトルトを用いる「レトルト法」と、耐火レンガの炉内で電気加熱を行う「電気炉法」、微粉黒鉛を用いる「流動法」[9]がある[10]。低温で反応させると、一硫化炭素が発生する。
「CS2」の例文・使い方・用例・文例
- cs 2のページへのリンク