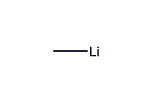メチルリチウム
出典: フリー百科事典『ウィキペディア(Wikipedia)』 (2025/03/28 13:45 UTC 版)
| メチルリチウム | |
|---|---|
 |
|
|
Methyllithium |
|
|
別称
Lithium methanide
リチウムメタニド |
|
| 識別情報 | |
| CAS登録番号 | 917-54-4 |
| PubChem | 2724049 |
| ChemSpider | 10254338 |
| 日化辞番号 | J1.231I |
| EC番号 | 213-026-4 |
| ChEBI | |
| バイルシュタイン | 3587162 |
| Gmelin参照 | 288 |
|
|
|
|
| 特性 | |
| 化学式 | CH3Li |
| モル質量 | 21.98 g mol−1 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
メチルリチウム (methyllithium) は化学式 CH3Li で表される有機リチウム化合物である。メチル基を Me と略記し、MeLi とも表記される。溶液中および固体状態では会合体(クラスター)を形成している。反応性が非常に高く、炭化水素溶液やエーテル溶液として有機合成などに用いられる。水や酸素に弱いため、無水・無酸素条件下で取り扱う必要がある。普通は実験室で調製されることはなく、溶液が広く市販されている。
合成
もうひとつは六量体で、LiとCがそれぞれ交互に頂点に配置された、ゆがんだ六面体型のクラスターである。
どちらのクラスターが生成しやすいかは溶媒や添加剤(臭化リチウムなど)の有無によって決まる。ベンゼンなどの炭化水素溶媒中では六量体が[3]、エーテル溶媒中では四量体が得られやすい。
結合
上記のクラスターはオクテット則を満たさない原子を含む、電子不足な化合物である。つまり一般的な有機化合物に見られる2中心2電子結合を形成するのに十分な電子を持っていない。六量体には30個の電子(価電子)があるが、そのうち18個はC−H結合に使われ、のこり12個がクラスター形成に使われる。リチウム−リチウム結合に6個の電子が割り当てられ、6個のメチル基はおのおの1個ずつの電子によってη3型の結合をリチウム原子と形成する。
IR測定からC−Li結合のエネルギーは57 kcal/molと見積もられている[3]。
参考文献
- ^ Lusch, M. J.; Phillips, M. V.; Sieloff, W. V.; Nomura, G. S.; House, H. O. (1984). "Preparation of Low-Halide Methyllithium". Organic Syntheses (英語). 62: 101.; Collective Volume, vol. 7, p. 346
- ^ Elschenbroich, C. "Organometallics"; Wiley-VCH: Weinheim, 2006. ISBN 3527293906.
- ^ a b Brown, T. L.; Rogers, M. T. (1957). “The Preparation and Properties of Crystalline Lithium Alkyls”. J. Am. Chem. Soc. 79: 1859–1861. doi:10.1021/ja01565a024.
関連項目
メチル=リチウムと同じ種類の言葉
- メチル=リチウムのページへのリンク